
分析 (1)每克脂肪在人体内氧化分解产生约为37.6kJ的热量,葡萄糖约为16.4kJ,蛋白质约为16.7kJ;
(2)碘盐就是在食盐中加入一定量的碘酸钾(KIO3);
(3)维生素既不参与构成人体细胞,也不为人体提供能量,而且人体对它的需要量很小,但它对人体的各项生命活动有重要的作用;人体一旦缺乏维生素,就会影响正常的生长和发育,还会引起疾病;
(4)身材矮小可能是由于缺钙,缺铁会患贫血,血液输送氧气的能力下降.
解答 解:(1)每克脂肪在人体内氧化分解产生约为37.6kJ的热量,葡萄糖约为16.4kJ,蛋白质约为16.7kJ,提供能量最多的是油脂,故答案为:B;
(2)食盐加碘添加碘酸钾,故答案为:C;
(3)人体一旦缺乏维生素,就会影响正常的生长和发育,还会引起疾病,如图
坏血病、牙龈经常出血的人,是体内缺乏维生素C造成的,新鲜蔬菜和水果中富含维生素C,可见C正确,故答案为:C.
(4)身材矮小,腰背弯曲可能是由于缺钙,缺铁会患贫血,血液输送氧气的能力下降,故答案为:钙;氧气.
点评 本题考查了人体中的供能物质、食品添加剂和维生素,题目难度不大,注意利用化学知识来解决生活中的问题.


 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:解答题
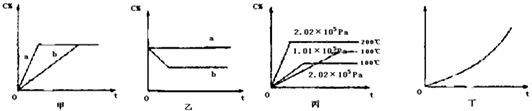
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化氢的电子式: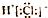 | |
| B. | 乙烷的结构简式:C2H6 | |
| C. | 铝的原子结构示意图: | |
| D. | 硫酸钠的电离方程式:Na2SO4=2Na++$S{{O}_{4}}^{2-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%.
中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com