
| A. | 蛋白质 | B. | 糖类 | C. | 油脂 | D. | 维生素 |
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
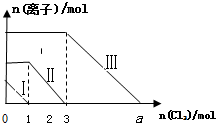 向仅含Fe2+、I-、Br-的溶液通入适量氯气,溶液中这三种离子的物质的量的变化如图所示. (已知氧化性:Br2>Fe3+>I2)请回答下列问题:
向仅含Fe2+、I-、Br-的溶液通入适量氯气,溶液中这三种离子的物质的量的变化如图所示. (已知氧化性:Br2>Fe3+>I2)请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 将氢氧化钠固体放在滤纸上称量 | |
| B. | 用10ml量筒量取8.58ml蒸馏水 | |
| C. | 容量瓶定容时观察液面时俯视,会使配得的溶液浓度偏大 | |
| D. | 用托盘天平可以称量至0.1g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,以任意比例混合的甲烷和乙烯混合物22.4 L充分燃烧,生成物中水的分子数为2NA | |
| B. | 标准状况下,11.2L辛烷完全燃烧后,所生成气态产物的分子数为4NA | |
| C. | 常温常压下,1mol苯中含有3NA碳碳双键、3NA碳碳单键 | |
| D. | 常温常压下,1 mol甲烷和1mol氯气光照反应生成2NA个气体分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  和 和 | |
| B. | CH3-CH2NO2和H2N-CH2-COOH | |
| C. | CH2═CH-CH2-COOH和CH3-CH═CH-COOH | |
| D. | CH3-CH2-O-CH2-CH3和 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 离子组 | 加入试剂 | 发生反应的离子方程式 |
| A | Fe3+、S2ˉ、Clˉ、Na+ | NaOH溶液 | Fe3++3OHˉ═Fe(OH)3↓ |
| B | H+、Fe2+、SO42ˉ、NO3ˉ | BaCl2溶液 | SO42ˉ+Ba2+═BaSO4↓ |
| C | Na+、Al3+、Clˉ、SO42ˉ | 少量KOH溶液 | Al3++3OHˉ═Al(OH)3↓ |
| D | Na+、K+、ClOˉ、SO42ˉ | 通入少量SO2 | 2ClOˉ+SO2+H2O═2HClO+SO32ˉ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 化学反应中所释放的热量在工业生产和科学研究中有着重要的作用.
化学反应中所释放的热量在工业生产和科学研究中有着重要的作用.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com