

| A. | 温度相同(>t1℃)时,KNO3溶液中溶质的质量分数大于NaCl溶液中溶质的质量分数 | |
| B. | t1℃时,KNO3、NaCl饱和溶液中溶质的物质的量浓度相等 | |
| C. | 用“溶解→蒸发→趁热过滤”方法可提纯含有少量KNO3杂质的NaCl固体 | |
| D. | 将50g KNO3饱和溶液从t2℃降至t1℃,析出固体质量小于0.5(b-a)g |
分析 A.温度相同(>t1℃)时,KNO3的溶解度大于NaCl的溶解度,但选项中溶液不一定为饱和溶液,不能确定质量分数大小;
B.t1℃时,KNO3、NaCl的溶解度相等,二者饱和溶液中溶质的质量分数相等;
C.高于t2℃后,KNO3的溶解度原大于NaCl,KNO3的溶解度受温度影响比较大,而NaCl溶解度受温度影响不大,可以利用蒸发结晶进行提纯;
D.100g水从t2℃降至t1℃,可以析出(b-a)g KNO3,50g KNO3饱和溶液中水的质量小于50g,
解答 解:A.温度相同(>t1℃)时,KNO3的溶解度大于NaCl的溶解度,若为饱和溶液,KNO3溶液中溶质的质量分数大于NaCl溶液中溶质的质量分数,但选项中溶液不一定为饱和溶液,不能确定质量分数大小,故A错误;
B.t1℃时,KNO3、NaCl的溶解度相等,二者饱和溶液中溶质的质量分数相等,但物质的量浓度不相等,故B错误;
C.高于t2℃后,KNO3的溶解度原大于NaCl,KNO3的溶解度受温度影响比较大,而NaCl溶解度受温度影响不大,用“溶解→蒸发→趁热过滤”方法可提纯含有少量KNO3杂质的NaCl固体,故C正确;
D.100g水从t2℃降至t1℃,可以析出(b-a)g KNO3,50g KNO3饱和溶液中水的质量小于50g,故将50g KNO3饱和溶液从t2℃降至t1℃,析出固体质量小于0.5(b-a)g,故D正确,
故选:CD.
点评 本题考查溶解度、溶解度曲线及其应用、物质的分离提纯等,侧重考查学生的分析计算能力,难度中等.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)周期表前四周期元素中,基态原子中未成对电子数与其所在周期序数相同的元素有5种,其中原子序数最大的元素价电子排布是为3d64s2
(1)周期表前四周期元素中,基态原子中未成对电子数与其所在周期序数相同的元素有5种,其中原子序数最大的元素价电子排布是为3d64s2
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
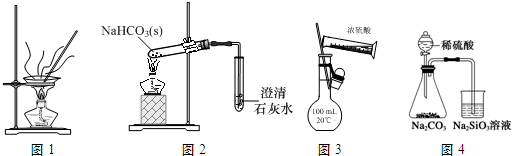
| A. | 用图1装置灼烧CuSO4•5H2O晶体除去结晶水 | |
| B. | 用图2装置探究NaHCO3的热稳定性 | |
| C. | 用图3装置配制100 mL 0.1 mol•L-1的硫酸 | |
| D. | 用图4装置比较硫、碳、硅三种元素的非金属性强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 钛是一种性能非常优越的金属,被称为继铁、铝之后的第三金属.
钛是一种性能非常优越的金属,被称为继铁、铝之后的第三金属.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1molFe在0.1mol氯气中充分燃烧时转移的电子数为0.3NA | |
| B. | 0.1mol乙烷和丙烯的混合物所含氢原子数目为0.6NA | |
| C. | 64g的SO2与足量的O2充分反应后可得到NA个S03分子 | |
| D. | 标准状况下,2.24L HF含有的分子数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a=b=100mL | B. | a=b=1000mL | C. | a<b | D. | a>b |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com