
(共6分) 实验室制备少量硅一般采用镁粉还原SiO2的方法,然后用稀盐酸洗涤产品以除去杂质。某同学在进行上述操作时,在制得的产品中加HCl洗涤时突然起火。
(1) 请用化学方程式解释:
①稀盐酸洗涤产品可除去哪些主要杂质?
②为什么加HCl洗涤时突然起火?
(2) 请设计一个实验来验证你的解释。(不必画出装置图,也不必指出具体化学药品,不要写方程式,只要简明指出方法。)
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2011-2012学年山西省临汾一中高一6月月考化学试卷(带解析) 题型:填空题
(1)下面各个小题已经给出了化学反应的反应物,试写出完整的化学反应方程式并配平:(每小题2分,共6分)
过量乙酸与甘油的酯化反应
蔗糖水解:
CH3CH(OH)CH3的催化氧化:
(2)(4分).硫-碘循环分解水制氢主要涉及下列反应:
Ⅰ.SO2+2H2O+I2===H2SO4+2HI Ⅱ.2HI H2+I2 Ⅲ.2H2SO4===2SO2+O2+2H2O
H2+I2 Ⅲ.2H2SO4===2SO2+O2+2H2O
(1)一定温度下,向1L密闭容器中加入1mol HI(g),发生反应Ⅱ,生成的I2为气体,H2物质的量随时间的变化如图所示。0-2 min内的平均反应速率υ(HI)= 
(2)实验室用Zn和硫酸制取H2,为了加快反应速率,下列措施不可行的是 (填序号)
a.加入浓硝酸 b.加入少量CuSO4固体 c.用粗锌代替纯锌
d.加热 e.把锌粒弄成锌粉 f.用98.3%浓硫酸
查看答案和解析>>
科目:高中化学 来源:2014届山西省高一6月月考化学试卷(解析版) 题型:填空题
(1)下面各个小题已经给出了化学反应的反应物,试写出完整的化学反应方程式并配平:(每小题2分,共6分)
过量乙酸与甘油的酯化反应
蔗糖水解:
CH3CH(OH)CH3的催化氧化:
(2)(4分).硫-碘循环分解水制氢主要涉及下列反应:
Ⅰ.SO2+2H2O+I2===H2SO4+2HI
Ⅱ.2HI H2+I2 Ⅲ.2H2SO4===2SO2+O2+2H2O
H2+I2 Ⅲ.2H2SO4===2SO2+O2+2H2O
(1)一定温度下,向1L密闭容器中加入1mol HI(g),发生反应Ⅱ,生成的I2为气体,H2物质的量随时间的变化如图所示。 0-2 min内的平均反应速率υ(HI)=

(2)实验室用Zn和硫酸制取H2,为了加快反应速率,下列措施不可行的是 (填序号)
a.加入浓硝酸 b.加入少量CuSO4 固体 c.用粗锌代替纯锌
d.加热 e.把锌粒弄成锌粉 f.用98.3%浓硫酸
查看答案和解析>>
科目:高中化学 来源:2011-2012学年上海市浦东新区高三下学期4月质量抽测化学试卷(解析版) 题型:填空题
(本题共12分)铬铁矿的主要成分可表示为FeO·Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,以下是以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的流程图:
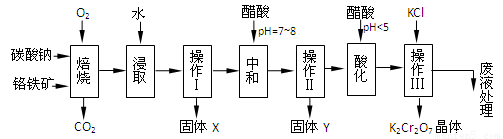
已知:①4FeO·Cr2O3+ 8Na2CO3+ 7O2 8Na2CrO4
+ 2 Fe2O3 + 8CO2↑;
8Na2CrO4
+ 2 Fe2O3 + 8CO2↑;
②Na2CO3 + Al2O3 2NaAlO2
+ CO2↑;③ Cr2O72-+ H2O
2NaAlO2
+ CO2↑;③ Cr2O72-+ H2O 2CrO42- + 2H+
2CrO42- + 2H+
根据题意回答下列问题:
1.固体X中主要含有_________(填写化学式);要检测酸化操作中溶液的pH是否等于4.5,应该使用__________(填写仪器或试剂名称)。
2.酸化步骤用醋酸调节溶液pH<5,其目的是_________________________________。
3.操作Ⅲ有多步组成,获得K2Cr2O7晶体的操作依次是:加入KCl固体、蒸发浓缩、 、过滤、_______、干燥。
4.下表是相关物质的溶解度数据,操作Ⅲ发生反应的化学方程式是:Na2Cr2O7+2KCl → K2Cr2O7↓+2NaCl。该反应在溶液中能发生的理由是_______________。
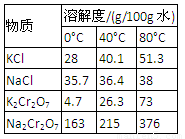
5.副产品Y主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,精确分析Y中氢氧化铝含量的方法是称取n g样品,加入过量______(填写试剂)、溶解、过滤、再______(填写试剂)、……灼烧、冷却、称量,得干燥固体m g 。计算样品中氢氧化铝的质量分数为_________(用含m、n的代数式表示)。
6.六价铬有毒,而Cr3+相对安全。工业含铬(CrO3)废渣无害化处理的方法之一是干法解毒,用煤不完全燃烧生成的CO还原CrO3。在实验室中模拟这一过程的装置如下:
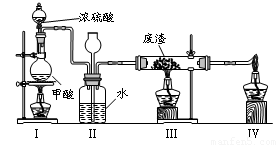
CO由甲酸脱水制得;实验结束时熄灭酒精灯的顺序是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
![]() (共6分,)实验室常用反应:MnO2+4HCl(浓) MnCl2+Cl2↑+H2O 来制取氯气。用400g 36.5%的浓盐酸与二氧化锰反应, 现制得标准状况下的氯气4.48L,试回答下列问题:
(共6分,)实验室常用反应:MnO2+4HCl(浓) MnCl2+Cl2↑+H2O 来制取氯气。用400g 36.5%的浓盐酸与二氧化锰反应, 现制得标准状况下的氯气4.48L,试回答下列问题:
⑴ 理论上需要多少克二氧化锰?(要求写出计算过程)
⑵ 将反应后剩余的溶液,用水稀释至500mL,求稀释后溶液中Cl—的物质的量浓度?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com