
【题目】下列有关实验的叙述正确的是
A.过滤时,可用玻璃棒搅拌漏斗中的液体以加快过滤速率
B.用湿润的pH试纸测溶液的pH,因溶液被稀释而使测量值变大
C.酸碱滴定管、容量瓶、分液漏斗使用前必须检查是否漏水
D.酸碱滴定实验中,需用待滴定溶液润洗锥形瓶以减小实验误差
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列说法正确的是( )
A.标准状况下,22.4 L H2O中含有氢原子数目为2NA
B.17 g NH3所含质子数为10NA
C.0.1mol Cu(NO3)2中含有的离子数目为0.2NA
D.28g N2 体积为22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
A. 23g Na 与足量H2O反应完全后可生成NA个H2分子
B. 1 molCu和足量热浓硫酸反应可生成NA个SO3分子
C. 标准状况下,22.4LN2和H2混合气中含NA个原子
D. 3mol单质Fe完全转变为Fe3O4,失去8NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应3H2(g) + N2(g)=2NH3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是
A. 增大压强 B. 充入更多N2 C. 使用高效催化剂 D. 降低温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应在常温下均为非自发反应,则在高温下仍为非自发的是
A.2CO(g)=2 C(s)+ O2(g)
B.2CuO(s)=Cu2O(s)+1/2O2(g)
C.MgCO3(s)=MgO(s)+CO2 (g)
D.SnO2(s)+C(s)=Sn(s)+CO2 (g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化钾样品中含有少量碳酸钾、硫酸钾和不溶于水的杂质。为了提纯氯化钾,先将样品溶于适量水中,充分搅拌后过滤,在将滤液按下图所示步骤进行操作。
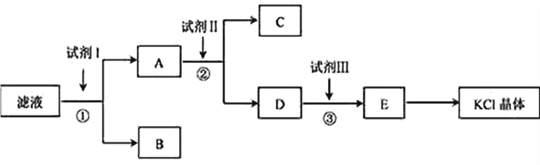
回答下列问题:
(1)起始滤液的pH_______7(填“大于”、“小于”或“等于”),其原因是______________。
(2)试剂I的化学式为________,①中发生反应的离子方程式为_________________________。
(3)试剂Ⅱ的化学式为___________,②中加入试剂Ⅱ的目的是__________________________;
(4)试剂Ⅲ的名称是___________,③中发生反应的离子方程式为________________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从下列现象可以判断某一元酸是强酸的是( )
A.加热该酸至沸腾也不分解
B.该酸可以与石灰石反应放出CO2
C.该酸可以把Al(OH)3沉淀溶解
D.该酸浓度为0.1 mol·L-1时的pH为1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“钴酞菁”分子(直径约为1.34x10-9m)结构和性质与人体内的血红素及植物内的叶绿素非常相似。下列关于“钴酞菁”分子的说法中正确的是
A. “钴酞菁”分子在水中所形成的分散系属悬浊液
B. “钴酞菁”分子既能透过滤纸,也能透过半透膜
C. 在分散系中,“钴酞菁”分子直径比Na+的直径小
D. “钴酞菁”分子在水中形成的分散系能产生丁达尔现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在高温高压下CO具有极高的化学活性,能与多种单质或化合物反应.
(1)若在恒温恒容的容器内进行反应C(s)+H2O(g)CO(g)+H2(g),则可用来判断该反应达到平衡状态的标志有 . (填字母)
a.容器内的压强保持不变
b.容器中H2浓度与CO浓度相等
c.容器中混合气体的密度保持不变
d.CO的生成速率与H2的生成速率相等
(2)CO一空气燃料电池中使用的电解质是搀杂了Y2O3的ZrO2晶体,它在高温下能传导O2 . 该电池负极的电极反应式为 .
(3)一定条件下,CO与H2可合成甲烷,反应方程式为:CO(g)+3H2(g)CH4(g)+H2O(g)
①一定条件下,该反应能够自发进行的原因是 .
②已知H2(g)、CO(g)和 CH4(g)的燃烧热分别为285.8kJmol﹣1、283.0kJmol﹣1和890,0kJmol﹣1 .
写出CO与H2反应生成CH4和CO2的热化学方程式:
(4)工业上可通过甲醇羰基化法制取甲酸甲酯,反应方程式为:CH3OH(g)+CO(g) ![]() HCOOCH3(g)△H=﹣29.1kJmol﹣1 . 科研人员对该反应进行了研究.部分研究结果如图所示:
HCOOCH3(g)△H=﹣29.1kJmol﹣1 . 科研人员对该反应进行了研究.部分研究结果如图所示: 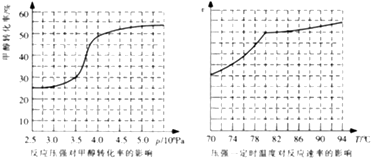
①从反应压强对甲醇转化率的影响“效率“看,工业制取甲酸甲酯应选择的压强是 .
②实际工业生产中采用的温度是80℃,其理由是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com