
【题目】在200 mL含Mg2+、Al3+、NH4+、H+、Cl-等离子的溶液中,逐滴加入5molL-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示。下列叙述正确的是( )

A.x与y的差值为0.02mol
B.原溶液中c(Cl-)=0.75mol·L-1
C.原溶液的pH=1
D.原溶液中n(Mg2+)∶n(Al3+)=5∶2
【答案】C
【解析】
在200mL含Mg2+、Al3+、NH4+、H+、Cl-等离子的溶液中,逐滴加入5molL-1的NaOH溶液,加入4mLNaOH溶液时没有沉淀生成,说明H+先和NaOH反应,则溶液中含有H+,c(H+)=![]() =0.1mol/L,继续滴加NaOH溶液,沉淀的量逐渐增大,30mLNaOH溶液后,继续滴加NaOH溶液,沉淀的物质的量不变,则溶液中含有NH4+,则c(NH4+)=
=0.1mol/L,继续滴加NaOH溶液,沉淀的量逐渐增大,30mLNaOH溶液后,继续滴加NaOH溶液,沉淀的物质的量不变,则溶液中含有NH4+,则c(NH4+)=![]() =0.075mol/L,继续滴加NaOH,沉淀溶解,35mLNaOH后,沉淀不溶解,说明溶液中含有Mg2+、Al3+,根据Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-=AlO2-+2H2O知,生成氢氧化铝沉淀和生成偏铝酸根离子需要氢氧化钠体积之比为3:1,则生成氢氧化铝沉淀需要NaOH体积=(35-33)mL×3=6mL,则生成氢氧化镁需要NaOH体积=(30mL-4mL)-6mL=20mL,则c(Mg2+)=
=0.075mol/L,继续滴加NaOH,沉淀溶解,35mLNaOH后,沉淀不溶解,说明溶液中含有Mg2+、Al3+,根据Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-=AlO2-+2H2O知,生成氢氧化铝沉淀和生成偏铝酸根离子需要氢氧化钠体积之比为3:1,则生成氢氧化铝沉淀需要NaOH体积=(35-33)mL×3=6mL,则生成氢氧化镁需要NaOH体积=(30mL-4mL)-6mL=20mL,则c(Mg2+)=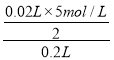 =0.25mol/L,c(Al3+)=
=0.25mol/L,c(Al3+)=![]() =0.05mol/L,溶液中存在电荷守恒,根据电荷守恒得3c(Al3+)+2c(Mg2+)+c(NH4+)+c(H+)=c(Cl-)=[3×0.05+2×0.25+0.075+0.1]mol/L=0.825mol/L,据此分析解答。
=0.05mol/L,溶液中存在电荷守恒,根据电荷守恒得3c(Al3+)+2c(Mg2+)+c(NH4+)+c(H+)=c(Cl-)=[3×0.05+2×0.25+0.075+0.1]mol/L=0.825mol/L,据此分析解答。
A. x为Al(OH)3、Mg(OH)2的物质的量,y为Mg(OH)2的物质的量,二者的差为Al(OH)3的物质的量=0.05mol/L×0.2L=0.01mol,A项错误;
B. 原溶液中c(Cl)=0.825mol/L,B项错误;
C. 通过分析知,c(H+)=0.1mol/L,原溶液的pH=1,C项正确;
D. 通过以上分析知,c(Mg2+)=0.25mol/L,c(Al3+)=0.05mol/L,同一溶液中体积相等,其物质的量之比等于物质的量浓度之比=0.25mol/L:0.05mol/L=5:1,D项错误;
答案选C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】关于阿佛加德罗常数(NA)的说法中错误的是( )
A. 等物质的量的CH4和H2O,核外电子总数均为10NA
B. 12克NaHSO4和MgSO4的固体混合物中含阳离子数为0.1NA
C. 反应2NH4ClO4![]() N2↑+Cl2↑+2O2↑+4H2O,每产生1molO2转移电子数为7NA
N2↑+Cl2↑+2O2↑+4H2O,每产生1molO2转移电子数为7NA
D. 100g质量分数为46%C2H5OH溶液中,含氢原子数为12NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下, 0.1 mol/L的某二元酸 H2A 溶液中,可能存在的所有含 A 粒子的物质的量分数随pH 变化的关系如图所示。下列说法正确的是

A. H2A 的电离方程式:H2A![]() H+ + HA-
H+ + HA-
B. pH = 5 时,在NaHA和Na2A的混合溶液中: c(HA-) : c(A2-)= 1 : 100
C. 等物质的量浓度的NaHA和Na2A溶液等体积混合,离子浓度大小关系为:c(Na+)>c(HA-)>c(A2-)
D. NaHA溶液显碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向绝热恒容密闭容器中通入SO2和NO2,在一定条件下使反应SO2(g)+NO2(g)SO3(g)+NO(g)达到平衡,正反应速率随时间变化的如上图所示.由图可得出的正确结论是( )
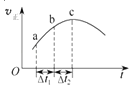
A.反应物的总能量低于生成物的总能量
B.反应物浓度:a点小于b点
C.△t1=△t2时,SO2的转化率:a~b段小于b~c段
D.反应在c点达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,Ag2SO4在水中的沉淀溶解平衡曲线如图所示。该温度下,下列说法正确的是

A. 含有大量SO42-的溶液中肯定不存在Ag+
B. Ag2SO4的溶度积常数(Ksp)为1×10-3
C. 0.02 mol·L-1的AgNO3溶液与0.02 mol·L-1的Na2SO4溶液等体积混合不会生成沉淀
D. a点表示Ag2SO4的不饱和溶液,蒸发可以使溶液由a点变到b点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿水青山就是金山银山”,因此研究NOx、SO2等大气污染物的妥善处理具有重要意义。
(1)SO2的排放主要来自于煤的燃烧,工业上常用氨水吸收法处理尾气中的SO2。已知吸收过程中相关反应的热化学方程式如下:
①SO2(g)+NH3·H2O(aq)==NH4HSO3(aq) △H1=akJ·mol-1;
②NH3·H2O(aq)+NH4HSO3(aq)==(NH4)2SO3(ag)+H2O(l) △H2=bkJ·mol-1;
③2(NH4)2SO3(aq)+O2(g)==2(NH4)2SO4(aq) △H3=ckJ·mol-1。
则反应2SO2(g)+4NH3·H2O(aq)+O2(g)==2(NH4)2SO4(aq)+2H2O(1)的△H=___________kJ·mol-1。
(2)燃煤发电厂常利用反应2CaCO3(s)+2SO2(g)+O2(g)===2CaSO4(s)+2CO2(g)
△H=-681.8kJ·mol-1对煤进行脱硫处理来减少SO2的排放。对于该反应,在T℃时,借助传感器测得反应在不同时间点上各物质的浓度如下:
0 | 10 | 20 | 30 | 40 | 50 | |
O2 | 1.00 | 0.79 | 0.60 | 0.60 | 0.64 | 0.64 |
CO2 | 0 | 0.42 | 0.80 | 0.80 | 0.88 | 0.88 |
①0~10min内,平均反应速率v(O2)___________mol·L-1·min-1;当升高温度,该反应的平衡常数K___________(填“增大”“减小”或“不变”)。
②30min后,只改变某一条件,反应重新达到平衡。根据上表中的数据判断,改变的条件可能是___________(填字母)。
A加入一定量的粉状碳酸钙 B通入一定量的O2
C适当缩小容器的体积 D加入合适的催化剂
(3) NOx的排放主要来自于汽车尾气,人利用反应
C(s)+2NO(g)![]() N2(g)+CO2(g) △H=-34.0kJ·mol-1,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:
N2(g)+CO2(g) △H=-34.0kJ·mol-1,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:

由图可知,1050K前反应中NO的转化率随温度升髙而增大,其原因为____________________;在1100K时,CO2的体积分数为___________。
(4)用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在1050K、1.1×106Pa时,该反应的化学平衡常数Kp=___________[已知:气体分压(P分)=气体总压(Pa)×体积分数]。
(5)为避免汽车尾气中的有害气体对大气的污染,需给汽车安装尾气净化装置。在净化装置中CO和NO发生反应2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H=-746.8k·mol-1,生成无毒的N2和CO2。实验测得,v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2) ·c2(CO2)(k正、k逆为速率常数,只与温度有关)。
N2(g)+2CO2(g) △H=-746.8k·mol-1,生成无毒的N2和CO2。实验测得,v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2) ·c2(CO2)(k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,k正增大的倍数___________(填“>”“<”或“=”)k逆增大的倍数。
②若在1L的密闭容器中充入1 molCO和1 molNO,在一定温度下达到平衡时,CO的转化率为40%,则![]() =___________。
=___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:10AgF+5Cl2+5H2O=9AgCl+AgClO3+10HF+O2,试回答:
(1)反应中氧化剂和还原剂的物质的量之比是_____;
(2)当转移1 mol电子时,被氧化的Cl2的物质的量是___;
(3)每产生1 mol O2时,被氧元素还原的Cl2的物质的量是_____;
(4)反应消耗的水是(_____)
A.全部被氧化 B.全部被还原 C.![]() 被氧化 D.
被氧化 D.![]() 被还原
被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用18.4mol/L的浓硫酸配制100mL浓度为1mol/L的稀硫酸。
(1)需要使用的主要仪器有量筒、烧杯、玻璃棒、__________、___________。
(2)其操作步骤可分解为以下几步:
a.用量筒量取_______mL浓硫酸,缓缓注入装有约50mL蒸馏水的烧杯里,并用玻璃棒搅拌
b.用约30mL蒸馏水分三次洗涤烧杯和玻璃棒,将每次的洗液都倒入容量瓶里
c.将稀释后的硫酸小心地用玻璃棒引流容量瓶里
d.检查100mL容量瓶,是否漏水
e.将蒸馏水直接加入容量瓶,至液面接近刻度线______________
f.盖紧瓶塞,反复颠倒振荡,摇匀溶液
g.用胶头滴管向容量瓶里逐滴加入蒸馏水,到液面最低点恰好与刻线相切
请据此填写:
①完成上述步骤中的空白处。
②正确的操作顺序是(用字母填写):( )→( )→( )→( )→( )→( )→(______)。
③进行A步操作后,选用量筒的规格是_______。
a.10mL b.50mL c.100mL d.1000mL
④如果对装有浓硫酸的量筒仰视读数,配制的稀硫酸浓度将_____(填“偏高”、“偏低”、“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、(1)在容量瓶上,无需标记的是(______)
A.刻度线 B.温度 C.浓度 D.容积
(2)用固体样品配制一定物质的量浓度的溶液,需经过称量、溶解、转移溶液、定容等操作。下列图示对应的操作规范的是(______)
A.称量 B.溶解
B.溶解
C.转移 D.定容
D.定容![]()
Ⅱ、实验室配制500mL 0.2mol·L-1的Na2SO4溶液,实验操作步骤有:
A.在天平上称出14.2g硫酸钠固体,把它放在烧杯中,用适量的蒸馏水使它完全溶解并冷却至室温。
B.把制得的溶液小心地转移到容量瓶中。
C.继续向容量瓶中加蒸馏水至液面距刻度线1~2cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面最低处与刻度线相切。
D.用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心注入容量瓶,并轻轻振荡。
E.将容量瓶瓶塞塞紧,充分摇匀后装瓶。
请填写下列空白:
(1)操作步骤的正确顺序为(填序号)_____。
(2)本实验用到的基本仪器已有烧杯、天平(带砝码、镊子)、玻璃棒,还缺少的仪器是_____、____。
(3)在配制过程中,其他操作都正确,下列操作会引起误差偏高的是____。(填序号)
①未洗涤烧杯、玻璃棒
②未等NaOH溶液冷却至室温就转移到容量瓶中
③容量瓶不干燥,含有少量蒸馏水
④定容时俯视刻度线
⑤定容时仰视刻度线
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com