
分析 在燃料电池中,燃料氢气在负极失电子发生氧化反应,氧气在正极得电子发生还原反应.
(1)若电解质溶液为KOH,负极上氢气失电子和氢氧根离子反应生成水,正极上氧气得电子和水生成氢氧根离子;
(2)酸性条件下,正极上氧气得电子和氢离子反应生成水,负极上氢气失电子生成氢离子.
解答 解:(1)若电解质溶液为KOH,负极上氢气失电子和氢氧根离子反应生成水,电极反应式为H2+2OH--2e-=2H2O,故答案为:H2+2OH--2e-=2H2O;
(2)酸性条件下,正极上氧气得电子和氢离子反应生成水,电极反应式为O2+4H++4e-=2H2O,故答案为:O2+4H++4e-=2H2O.
点评 本题考查电极反应式的书写,为高频考点,注意电解质溶液酸碱性对电极反应式的影响,书写电极反应式一定要结合电解质溶液酸碱性,题目难度中等.


 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源: 题型:选择题
| A. | SiO2+2NaOH═Na2SiO3+H2O | B. | H2SiO3$\frac{\underline{\;\;△\;\;}}{\;}$SiO2+H2O | ||
| C. | Na2SiO3+CO2+H2O═H2SiO3+Na2CO3 | D. | SiO2+CaCO3$\frac{\underline{\;高温\;}}{\;}$CaSiO3+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸、干冰、纯碱 | B. | 硝酸、二氧化硫、苛性钠 | ||
| C. | 盐酸、氧化铜、熟石灰 | D. | 醋酸、水、烧碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

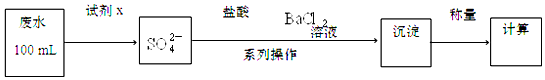
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ③②① | C. | ②③① | D. | ③①② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{94}^{239}$Pu与${\;}_{94}^{238}$Pu互为同位素 | |
| B. | ${\;}_{94}^{239}$Pu原子核外有94个电子 | |
| C. | ${\;}_{94}^{239}$Pu原子核中有94个中子 | |
| D. | ${\;}_{94}^{239}$Pu与${\;}_{92}^{238}$U为两种不同核素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠与盐酸反应最剧烈,产生的氢气最多 | |
| B. | 铝与盐酸反应的速率仅次于钠,产生的气体也没有钠与盐酸反应产生气体多 | |
| C. | 铁与盐酸反应产生的气体比铝与盐酸反应产生的气体多 | |
| D. | 铝与盐酸反应和铁与盐酸反应产生的气体一样多 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 胶体区别于其他分散系的本质特征是分散质的微粒直径在10-5:10-7m之间 | |
| B. | 光线透过胶体时,胶体中可发生丁达尔效应 | |
| C. | Fe(OH)3胶体能够使水中悬浮的固体颗粒沉降,达到净水目的 | |
| D. | 用平行光照射NaCl溶液和Fe(OH)3胶体时,产生的现象相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 体积数据 | B. | 体积分数 | C. | 质量分数 | D. | 物质的量浓度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com