
| A����AgClˮ��Һ�м��뱥��NaCl��Һ��c(Cl-)����AgCl���ܶȻ����� |
| B�������ܵ���ʷ��봿ˮ�У��ܽ��ƽ��ʱ����������ӵ�Ũ�ȵij˻����Ǹ����ʵ��ܶȻ� |
| C������AgCl�������Һ�м���������ˮʹAgCl�ܽ⣬���´ﵽƽ��ʱ��AgCl���ܶȻ����䣬���ܽ��Ҳ���� |
| D��AgCl��Ksp��1.8��10��10mol2��L��2�������κκ�AgCl�������Һ�У�c(Ag��)��c(Cl��)��Ag����Cl��Ũ�ȵij˻�����1.8��10��10mol2��L��2 |

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ�ʵ����

| | Fe3+ | Al3+ | Mg2+ |
| ��ʼ���� | 2��1 | 3��7 | 9��0 |
| ������ȫ | 3��2 | 5��2 | 12��4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��

| A��a���Ӧ��KSPС��c���Ӧ��KSP |
| B��a���Ϊb�㽫�г������� |
| C����������ˮ����ʹc���Ϊd�� |
D�����д��� ����Һ�п϶�������Ca2+ ����Һ�п϶�������Ca2+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��0.1mol/L NaCl��Һ | B��0.1mol/L NH4Cl��Һ |
| C��0.1mol/L KOH��Һ | D��0.1mol/L KAlO2��Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���٢� | B���ۢ� | C���٢ۢ� | D���٢ڢۢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����ˮ | B�����ᡡ | C��ˮ�� | D��AgNO3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���¶�һ��ʱ������Һ��c(Ag+)��c(Cl-)=Kspʱ������ҺΪAgCl�ı�����Һ |
| B��AgNO3��Һ��NaCl��Һ��Ϻ����Һ�У���һ����c(Ag+)=c(Cl-) |
| C����AgClˮ��Һ�м������ᣬKspֵ��� |
| D��������AgCl���뵽��Ũ��KI��Һ�У�����AgClת��ΪAgI��AgCl�ܽ��С��AgI |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��

| ģ�⺣ˮ�е� ����Ũ��(mol/L) | Na�� | Mg2�� | Ca2�� | Cl�D | 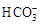 |
| 0.439 | 0.050 | 0.011 | 0.560 | 0.001 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com