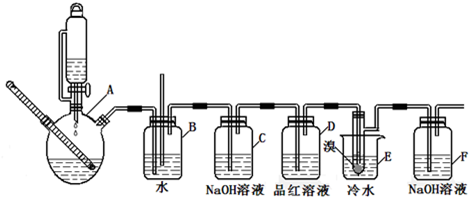
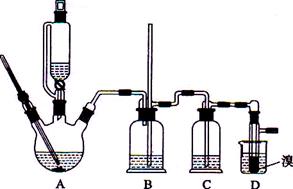
实验室制备1,2-二溴乙烷的反应原理如下:
CH
3CH
2OH
CH
2=CH
2CH
2=CH
2+Br
2BrCH
2CH
2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃分子间脱水生成乙醚.
用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如右图所示,有关数据列表如下:
|
乙醇 |
1,2-二溴乙烷 |
乙醚 |
| 状态 |
无色液体 |
无色液体 |
无色液体 |
| 密度/g?cm-3 |
0.79 |
2.2 |
0.71 |
| 沸点/℃ |
78.5 |
132 |
34.6 |
| 熔点/℃ |
一l30 |
9 |
-1l6 |
回答下列问题:
(1)装置A中需要加入碎瓷片或不断搅拌,其最主要目的是
防止爆沸
防止爆沸
;
(2)反应过程中应用冷水冷却装置D,但若过度冷却(如用冰水),B中可能的现象为:
B中长导管内液面上升
B中长导管内液面上升
.
(3)反应结束后,产物中可能有有少量未反应的Br
2,完成下列实验步骤提纯产品:
①将1,2-二溴乙烷粗产品置于
分液漏斗
分液漏斗
中;(填写仪器名称)
②加入
氢氧化钠溶液
氢氧化钠溶液
,充分振荡反应后静置,
③产物应在
下
下
层(填“上”、“下”);
(4)检验产物1,2-二溴乙烷中含有溴元素,实验方法为:
取少量产物于试管中,入NaOH溶液,加热,反应后冷却,加入稀HNO3酸化后加入AgNO3溶液,生成淡黄色沉淀,证明含有溴元素
取少量产物于试管中,入NaOH溶液,加热,反应后冷却,加入稀HNO3酸化后加入AgNO3溶液,生成淡黄色沉淀,证明含有溴元素
;有机化学反应方程式为:
CH
2BrCH
2Br+2NaOH
OHCH
2BrCH
2OH+2NaBr
CH
2BrCH
2Br+2NaOH
OHCH
2BrCH
2OH+2NaBr
.
(5)处理上述实验后烧瓶A中废液的正确方法是
c
c
.
a.废液冷却后直接倒入下水道中
b.废液冷却后直接倒入空废液缸中
c.废液加入适量水稀释冷却后倒入废液缸.

 实验室制备1,2-二溴乙烷的反应原理如下:
实验室制备1,2-二溴乙烷的反应原理如下:

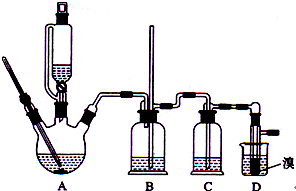 (2012?海南)实验室制备1,2-二溴乙烷的反应原理如下:
(2012?海南)实验室制备1,2-二溴乙烷的反应原理如下: