
 C,即正反应是体积减小的,C正确;0~4分钟时,A的变化量是0.4mol,所以A的反应速率是
C,即正反应是体积减小的,C正确;0~4分钟时,A的变化量是0.4mol,所以A的反应速率是 =0.01mol/(L?min),D正确,答案选A。
=0.01mol/(L?min),D正确,答案选A。

 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| t/min | X/mol | Y/mol | Z/mol |
| 0 | 1.00 | 2.00 | 0.00 |
| 1 | 0.90 | 1.80 | 0.20 |
| 3 | 0.75 | 1.50 | 0.50 |
| 5 | 0.65 | 1.30 | 0.70 |
| 9 | 0.55 | 1.10 | 0.90 |
| 10 | 0.55 | 1.10 | 0.90 |
| 14 | 0.55 | 1.10 | 0.90 |

查看答案和解析>>
科目:高中化学 来源: 题型:
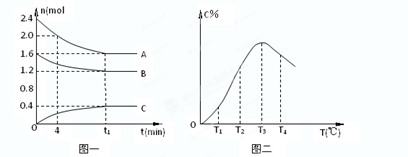
 在10L密闭容器中,某放热反应进行过程在不同反应时间各物质的量的变化情况如图所示(A、B、C均为气体),则:
在10L密闭容器中,某放热反应进行过程在不同反应时间各物质的量的变化情况如图所示(A、B、C均为气体),则:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
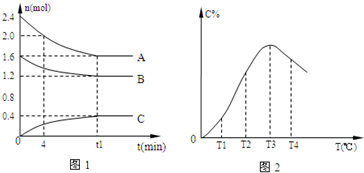
| A、0~4分钟时,A的平均反应速率为0.02mol/(L?min) | ||
B、该反应的平衡常数表达式K=
| ||
| C、由T1向T2变化时,V正>V逆 | ||
| D、此反应的正反应为放热反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com