
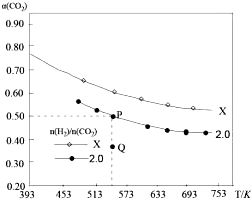
 �������̶��ݻ���Ϊ1L�ܱ��������Բ�ͬ����̼��$\frac{n��{H}_{2}��}{n��C{O}_{2}��}$����H2��CO2����һ�������·�����Ӧ��2CO2��g��+6H2 ��g��?C2H4��g��+4H2O��g����H��CO2��ƽ��ת����a��CO2�����¶ȵĹ�ϵ��ͼ��ʾ������˵����ȷ���ǣ�������
�������̶��ݻ���Ϊ1L�ܱ��������Բ�ͬ����̼��$\frac{n��{H}_{2}��}{n��C{O}_{2}��}$����H2��CO2����һ�������·�����Ӧ��2CO2��g��+6H2 ��g��?C2H4��g��+4H2O��g����H��CO2��ƽ��ת����a��CO2�����¶ȵĹ�ϵ��ͼ��ʾ������˵����ȷ���ǣ�������| A�� | �÷�Ӧ�ڸ������Է����� | |
| B�� | X����̼��X��2.0����Q������̼��Ϊ2.0ʱv��������v���棩 | |
| C�� | ����ʼʱ��CO2��H2Ũ�ȷֱ�Ϊ0.5mol/L��1.0mol/L����ɵõ�P�㣬��Ӧ�¶ȵ�ƽ�ⳣ����ֵΪ512 | |
| D�� | ����P��״̬�������У���2��4��1��4�ı����ٳ���CO2��H2��C2H4��H2O���ٴ�ƽ���a��CO2����С |
���� A����ͼ���֪�¶�����CO2��ת���ʽ��ͣ�˵��ƽ�������ƶ������H��0����ϡ�H-T•��S��0���Է������жϣ�
B������̼��Ϊ2.0ʱ��P���ƽ�⣬Q��δ��ƽ�⣬��ʱ������̼��ת���ʱ�ƽ��ʱС��˵����ʱҪ����ת������Ķ�����̼����Ӧ���������ƶ���
C������ʼʱ��CO2��H2Ũ�ȷֱ�Ϊ0.5mol/L��1.0mol/L����ʱ������̼��ת����Ϊ50%����������ʵ�ƽ��Ũ�ȣ��ɼ���ƽ�ⳣ����
D����2��4��1��4�ı����ٳ���CO2��H2��C2H4��H2O���൱���ٰ���4��10����CO2��H2����̼�ȴ���2��
��� �⣺A����ͼ���֪�¶�����CO2��ת���ʽ��ͣ�˵��ƽ�������ƶ������H��0���ɡ�S��0��֪��������¡�H-T•��S��0�������Է����У���A����
B������̼��Ϊ2.0ʱ��P���ƽ�⣬Q��δ��ƽ�⣬��ʱ������̼��ת���ʱ�ƽ��ʱС��˵����ʱҪ����ת������Ķ�����̼����Ӧ���������ƶ���������Ӧ���ʴ����淴Ӧ���ʣ���B����
C�� 2CO2��g��+6H2 ��g��?C2H4��g��+4H2O��g��
��ʼ 0.5 1 0 0
ת�� 0.25 0.75 0.125 0.5
ƽ�� 0.25 0.25 0.125 0.5
K=$\frac{0.125��0��{5}^{4}}{0.2{5}^{2}��0.2{5}^{6}}$=512����C��ȷ��
D����2��4��1��4�ı����ٳ���CO2��H2��C2H4��H2O���൱���ٰ���4��10����CO2��H2����̼�ȴ���2�����ƽ���a��CO2������D����
��ѡC��
���� ���⿼�黯ѧƽ�������Ӱ�����ء�ƽ�ⳣ������ѧƽ��ͼ��ȣ�Ϊ��Ƶ����ͳ������ͣ����ؿ����ͼ��ķ�����ȡ��Ϣ��������һ���Ѷȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����±������ǿ��Ĵ���Һ�ж��ܷ�����ȥ��Ӧ | |
| B�� | ±����������ȥ��Ӧ�IJ���һ����ϩ�� | |
| C�� | ֻ��������������й����� | |
| D�� | ������������ȱ��黥Ϊͬϵ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
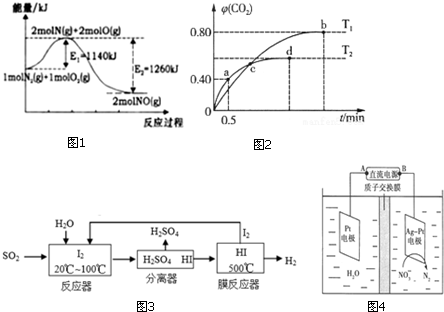
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
| Fe2O3 | CO | Fe | CO2 | |
| ��/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| ��/mol | 1.0 | 1.5 | 1.0 | 1.0 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
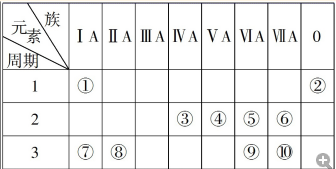
 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ��ѧʽ | H2��g�� | CO��g�� | CH3OH��l�� |
| ��ȼ���ȣ�25�棩 ��H/kJ•mol-1 | -285.8 | -283.0 | -726.5 |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
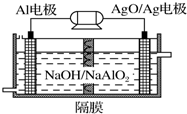 ���ǵؿ��к�����ߵĽ���Ԫ�أ��䵥�ʼ��Ͻ������������е�Ӧ�������㷺��
���ǵؿ��к�����ߵĽ���Ԫ�أ��䵥�ʼ��Ͻ������������е�Ӧ�������㷺���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 5�� | B�� | 4�� | C�� | 3�� | D�� | 2�� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com