
分析 (1)根据n=$\frac{△c}{△t}$计算v(W),再利用速率之比等于化学计量数之比计算v(X);
(2)利用速率之比等于化学计量数之比计算n.
解答 解:(1)2min 末已生成0.2mol W,则v(W)=$\frac{\frac{0.2mol}{2L}}{2min}$=0.05mol/(L.min),速率之比等于化学计量数之比,则v(X)=v(W)=0.05mol/(L.min),
答:前2min内用X的浓度变化表示的平均反应速率为0.05mol/(L.min);
(2)速率之比等于化学计量数之比,则0.05mol/(L.min):0.1mol/(L.min)=2:n,解得n=4,
答:n的值为4.
点评 本题考查化学平衡计算与反应速率计算,难度不大,反应速率一般利用定义式法与反应速率规律计算.


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:填空题
 向Ba(OH)2溶液中逐滴加入稀硫酸.请完成下列问题:
向Ba(OH)2溶液中逐滴加入稀硫酸.请完成下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
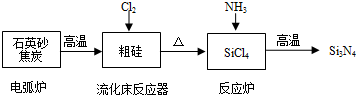
| 物质 | Si | SiCl4 | Cl2 |
| 沸点/℃ | 2355 | 57.6 | -34.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
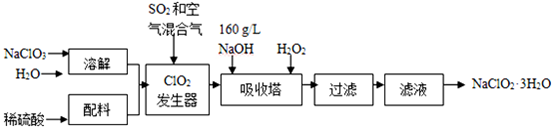
| 步骤I | 称取样品w g配成溶液置于锥形瓶中,并调节pH≤2.0 |
| 步骤II | 向锥形瓶中加入足量KI 晶体,充分搅拌,并加入少量指示剂 |
| 步骤III | 用c mol/L的Na2S2O3溶液滴定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | p(N2)>p(H2)>p(HCl) | B. | p(HCl)>p(N2)>p(H2) | C. | p(H2)>p(HCl)>p(N2) | D. | p(H2)>p(N2)>p(HCl) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图是向MgCl2、AlCl3混合溶液中,开始滴加6ml试剂A,之后改滴试剂B,所得沉淀y mol与试剂体积V(ml)间的关系.以下结论不正确的是( )
如图是向MgCl2、AlCl3混合溶液中,开始滴加6ml试剂A,之后改滴试剂B,所得沉淀y mol与试剂体积V(ml)间的关系.以下结论不正确的是( )| A. | A是NaOH,B是盐酸,且C(NaOH):C(HCl)=2:1 | |
| B. | 原混合液中,C(Al3+):C(Mg2+):C(Cl-)=1:1:5 | |
| C. | A是NaOH,B是盐酸,且C(NaOH):C(HCl)=1:2 | |
| D. | 从6到9,相应离子反应式H++OH-=H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com