
| A. | 纸层析法分离Fe2+和Cu2+实验中滤纸作为惰性支持物,滤纸上吸附的水作为流动相 | |
| B. | 硫酸亚铁铵晶体过滤后用无水乙醇洗涤,阿司匹林晶体过滤后时用水洗 | |
| C. | 牙膏中的安息香酸钠、氟化钠等溶于水,水解使溶液显酸性 | |
| D. | 欲分离KNO3和NaCl按物质的量1:1组成的混合物,先将样品溶解,然后加热至表面出现晶膜后冷却,过滤得KNO3晶体;将母液加热至大量晶体析出后,用余热蒸干,得NaCl晶体 |
分析 A.滤纸作为惰性支持物,滤纸上吸附的水作为固定相;
B.洗涤固体时,应尽量减少固体的溶解;
C.氟化钠、安息香酸钠都是强碱弱酸盐,其水溶液呈碱性;
D.母液中仍存在硝酸钾.
解答 解:A.滤纸作为惰性支持物,滤纸上吸附的水作为固定相,故A错误;
B.洗涤固体时,应尽量减少固体的溶解,硫酸亚铁铵晶体不溶于乙醇,阿司匹林晶体难溶于水,分别用乙醇和水洗涤,可减少固体的溶解,故B正确;
C.氟化钠、安息香酸钠都是强碱弱酸盐,安息香酸根离子和氟离子水解而使氟化钠、安息香酸钠溶液呈碱性,故C错误;
D.因NaCl的溶解度受温度影响不大,而硝酸钾的溶解度受温度影响较大,则样品溶解,然后加热至表面出现晶膜后再冷却,过滤得硝酸钾晶体,母液中仍存在硝酸钾不能分离完全,故D错误;
故选B.
点评 本题考查物质分离和提纯、盐类水解等知识点,明确物质性质及实验原理是解本题关键,易错选项是D,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①③④ | C. | ①②④ | D. | 只有③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 易燃试剂与强氧化性试剂分开放置并远离火源 | |
| B. | 用湿润的红色石蕊试纸检验氨气 | |
| C. | 在50 mL量筒中配制0.1mol•L-1碳酸钠溶液 | |
| D. | 金属钠着火时,用细沙覆盖灭火 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 往氢硫酸溶液中加入烧碱,有利于c(S2-)增大 | |
| B. | 经粉碎的黄铁矿燃烧得较快、较完全 | |
| C. | 实验室用排饱和食盐水的方法收集氯气 | |
| D. | 合成氨工厂通常采用20MPa~50MPa压强,以提高原料的利用率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ④①③⑥③ | B. | ④③①⑥⑤③ | C. | ①③②⑥③ | D. | ④①③⑤⑥③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 酸 | 电离平衡常数K |
| CH3COOH | 1.76×10-5 |
| H2CO3 | K1=4.31×10-7 K2=5.61×10-11 |
| H3PO4 | K1=7.52×10-3 K2=6.23×10-8 K3=2.20×10-13 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
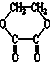 ⑤
⑤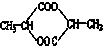 ⑥
⑥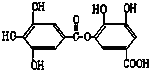 ⑦
⑦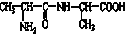 ,符合题意的物质可能是( )
,符合题意的物质可能是( )| A. | ①②⑤⑦ | B. | ②④⑤⑦ | C. | ②⑤⑥⑦ | D. | ①④⑤⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com