
| A、O.lmol/L NaHS溶液:c(H+)+c(Na+)=c(S2-)+c(HS-)+c(0H-) |
| B、O.lmol/L Na2C03溶液:c(H2CO3)+c(HCO3-)+c(CO32-)=0.lmol/L |
| C、pH=11的NaOH溶液与pH=3的CH3COOH溶液等体积混合:c(Na+)=c(CH3COO-)>c(OH-)=c(H+) |
| D、浓度均为0.1 mol/L的①NH4Cl②NH4Al(SO4)2③NH4HCO3三种溶液,其中c(NH4+):③>①>② |


科目:高中化学 来源: 题型:
| A、当盐酸加入10mL时,溶液中c(Na+)=2 c(HA-)+2c(A2-)+2 c(H2A) |
| B、当盐酸加入20mL时,溶液中c(Na+)>c(Cl-)>c(HA-)>c(H+)>c(OH-) |
| C、当盐酸加入20mL时,溶液中HA-的数目小于0.002NA |
| D、当盐酸加入40mL时,溶液中c(Na+)+c(H+)=c(OH-)+c(HA-)+c(A2-)+c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、200 mL,0.5mol?L-1的NaCl溶液 |
| B、100 mL,0.5mol?L-1的MgCl2溶液 |
| C、150 mL,1mol?L-1的NaCl溶液 |
| D、50 mL,0.5mol?L-1的AlCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(Na+)>c(A-)>c(H+)>c(OH-) |
| B、c(Na+)+c(H+)=c(A-)+c(OH-) |
| C、c(Na+)+c(OH-)=c(A-)+c(H+) |
| D、c(Na+)>c(OH-)>c(A-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、MnS的Ksp比CuS的Ksp大 | ||||
B、该反应达到平衡时:
| ||||
| C、往平衡体系中加入少量CuSO4固体后,c(Mn2+)变大 | ||||
| D、MnS(s)的浊液中加入少量可溶性MnSO4固体后,c(S2-)变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子半径大小顺序:r(W)>r(Z)>r(Y)>r(X) |
| B、元素Y的简单气态氢化物的热稳定性比Z的强 |
| C、由X、Y、Z三种元素形成的化合物的水溶液可能呈碱性 |
| D、化合物X2Z2与W2Z2所含化学键类型完全相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
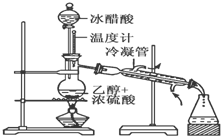 实验室合成乙酸乙酯的步骤如下:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸气冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏(如下图所示),得到含有乙醇、乙酸和水的乙酸乙酯粗产品.请回答下列问题:(已知:乙醇、乙酸、乙酸乙酯的沸点依次是78.4℃、118℃、77.1℃)
实验室合成乙酸乙酯的步骤如下:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸气冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏(如下图所示),得到含有乙醇、乙酸和水的乙酸乙酯粗产品.请回答下列问题:(已知:乙醇、乙酸、乙酸乙酯的沸点依次是78.4℃、118℃、77.1℃)查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com