
【题目】在恒温、容积为2 L的密闭容器中充入2 mol SO2和一定量O2。发生反应2SO2+O2 ![]() 2SO3 , 当反应进行到4 min时,测得n (SO2)=0.4 mol。若反应进行到2 min时,容器中SO2的物质的量是( )
2SO3 , 当反应进行到4 min时,测得n (SO2)=0.4 mol。若反应进行到2 min时,容器中SO2的物质的量是( )
A.等于1.6 mol
B.等于1.2 mol
C.小于1.2 mol
D.大于1.6 mol
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在理论上可用于设计原电池的化学反应是 ( )
A.2Al(s)十2NaOH(aq)+2H2O(1)=2NaAlO2(ag)+3H2(g);△H <0
B.Ba(OH)2·8H2O(s)+2NH4Cl(s)=BaCl2(aq)+2NH3·H2O(aq)+8H2O(1);△H >0
C.CaC2(s)+2H2O(1)→Ca(OH)2(s)+C2H2(g);△H <0
D.FeCl3(aq)十3H2O(1) ![]() Fe(OH)3(s)+3HCl(aq);△H >0
Fe(OH)3(s)+3HCl(aq);△H >0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对1mol H2O的说法正确的是( )
A.含有6.02×1023个氢分子B.含有6.02×2×1023个氢元素
C.质量为18gD.氢原子与氧原子的质量之比为2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应2C(g) ![]() A(g)+2B(g),已知△H<0,下列判断正确的是( )
A(g)+2B(g),已知△H<0,下列判断正确的是( )
A.仅常温下反应可以自发进行
B.仅高温下反应可以自发进行
C.任何温度下反应均可以自发进行
D.任何温度下反应均难以自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学—选修5:有机化学基础]有机物F是一种香料,其合成路线如图所示:
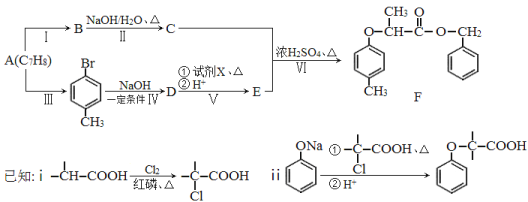
(1)A的名称为 ,试剂X的结构简式为 ,步骤Ⅵ的反应类型为 。
(2)步骤Ⅰ的反应试剂和条件分别为 、 。
(3)步骤Ⅱ反应的化学方程式为 。
(4)满足括号中条件(①苯环上只有两个取代基,②能与FeCl3溶液发生显色反应,③能发生水解反应和银镜反应)的E的同分异构体有 种,其中核磁共振氢谱峰面积比为6︰2︰2︰1︰1的分子的结构简式为 。
(5)依据题中信息,完成以![]() 为原料制取
为原料制取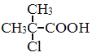 的合成路线图。
的合成路线图。
合成路线图示例如下:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物HIn在水溶液中因存在以下电离平衡,故可用作酸碱指示剂。( )
HIn(溶液) ![]() H+(溶液)+In-(溶液)
H+(溶液)+In-(溶液)
红色 黄色
浓度为0.02 mol·L-1的下列各溶液:①盐酸 ②石灰水 ③NaCl溶液 ④NaHSO4溶液 ⑤NaHCO3溶液 ⑥氨水
其中能使指示剂显红色的是
A.①③⑤
B.②⑤⑥
C.①④
D.②③⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关生物体内化学元素的叙述,错误的是( )
A.同一生物体不同组织细胞内化学元素种类和含量大体相同
B.C、H、O、N是组成生物体内酶所必需的元素
C.蛋白质中的S元素存在于氨基酸的R基中
D.占细胞的鲜重最多的元素是O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)丙烷(C3H8)是一种价格低廉的常用燃料,其主要成分是碳和氢两种元素,燃烧后只有二氧化碳和气态水,不会对环境造成污染。已知1 g丙烷完全燃烧放出50.45 kJ的热量。丙烷在室温下燃烧的热化学方程式为。
(2)高炉冶铁过程中,甲烷在催化反应室中产生水煤气(CO和H2)还原氧化铁,有关反应为:
CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH=+260 kJ·mol-1
已知:2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ·mol-1
则CH4与O2反应生成CO和H2的热化学方程式为;
(3)一定温度下,将1 mol N2O4 充入一恒压密闭容器中发生反应N2O4 (g) ![]() 2NO2 (g) ,下列示意图正确且能说明反应达到平衡状态的是。
2NO2 (g) ,下列示意图正确且能说明反应达到平衡状态的是。
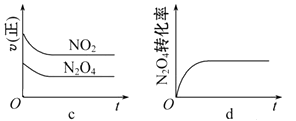
(4)在密闭容器中充入A(g)和B(g),它们的初始浓度均为2 mol·L-1 , 在一定条件下发生反应:A(g)+B(g) ![]() 2C(g) ΔH。该T1温度下,此反应的平衡常数为4,
2C(g) ΔH。该T1温度下,此反应的平衡常数为4,
①该反应的平衡常数的表达式为。
②A的转化率为。
③若升温至T2时,此反应的平衡常数为1,判断该反应ΔH0(填“>”或“<”);若在T2时,投入A、B、C三种物质的浓度均为3 mol·L-1 , 此时v(正)v(逆)。(填“>”、“<”或“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在做浓硫酸与铜反应的实验过程中,观察到铜片表面变黑,于是对黑色物质的组成进行实验探究。
(1)用如右图所示装置进行实验1。(加热和夹持仪器已略去)

实验1:铜片与浓硫酸反应
操作 | 现象 |
加热到120℃~250℃ | 铜片表面变黑,有大量气体产生,形成墨绿色浊液 |
继续加热至338℃ | 铜片上黑色消失,瓶中出现“白雾”,溶液略带蓝色,瓶底部有较多灰白色沉淀 |
①装置B的作用是________;装置C中盛放的试剂是_______。
②为证明A装置中灰白色沉淀的主要成分为硫酸铜,实验操作及现象是___________。
(2)探究实验1中120℃~250℃时所得黑色固体的成分。
【提出猜想】黑色固体中可能含有CuO、CuS、Cu2S中的一种或几种。
【查阅资料】
资料1:亚铁氰化钾[K4Fe(CN)6]是Cu2+的灵敏检测剂,向含有Cu2+的溶液中滴加亚铁氰化钾溶液,生成红棕色沉淀。
资料2:
CuS | Cu2S |
黑色结晶或粉末 | 灰黑色结晶或粉末 |
难溶于稀硫酸;可溶于硝酸;微溶于浓氨水或热的浓盐酸 | 难溶于稀硫酸和浓盐酸;可溶于硝酸;微溶于浓氨水 |
【设计并实施实验】
实验2.探究黑色固体中是否含CuO
操作 | 现象 |
i.取表面附着黑色固体的铜片5片,用清水洗干净,放入盛有10mL试剂A的小烧杯中,搅拌 | 黑色表层脱落,露出光亮的铜片 |
ii.取出铜片,待黑色沉淀沉降 | 上层溶液澄清、无色 |
①试剂A是_________。
②甲认为ii中溶液无色有可能是Cu2+浓度太小,于是补充实验确认了溶液中不含Cu2+,补充的实验操作及现象是______。
实验3.探究黑色固体中是否含CuS、Cu2S
操作 | 现象 |
i.取实验2中黑色固体少许,加入适量浓氨水,振荡后静置 | 有固体剩余,固液分界线附近的溶液呈浅蓝色 |
ii.另取实验2中黑色固体少许,加入适量浓盐酸,微热后静置 | 有固体剩余,溶液变成浅绿色 |
【获得结论】由实验2和实验3可得到的结论是:实验1中,120℃~250℃时所得黑色固体中_______。
【实验反思】
分析实验1中338℃时产生现象的原因,同学们认为是较低温度时产生的黑色固体与热的浓硫酸进一步反应造成。已知反应的含硫产物除无水硫酸铜外还有二氧化硫,则黑色固体消失时可能发生的所有反应的化学方程式为_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com