
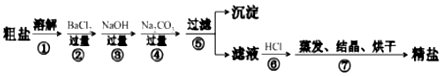
分析 根据除去粗盐中的泥沙、CaCl2、MgCl2、Na2SO4杂质,即除去镁离子、钙离子和硫酸根离子和泥沙,镁离子用氢氧根离子沉淀,硫酸根离子用钡离子沉淀,钙离子用碳酸根离子沉淀,样品溶解之后,可先加入氢氧化钠除去氯化镁,再加入氯化钡除去硫酸钠,或先加入氯化钡除去硫酸钠,再加入氢氧化钠除去氯化镁,最后加入碳酸钠,以除去CaCl2和过量的BaCl2,过滤要放在所有的沉淀操作之后,最后再用盐酸处理溶液中的碳酸根离子和氢氧根离子,最后户进行蒸发、结晶、烘干等操作得到精盐,以此解答该题.
解答 解:(1)用玻璃棒搅拌,加速了液体的流动,使固体很快溶解,故答案为:加速溶解;
(2)检验硫酸根离子,可用氯化钡检验,生成白色沉淀,方法是取少量上层清液置于试管中,滴加BaCl2溶液,看是否有白色沉淀生成,
故答案为:取少量上层清液置于试管中,滴加BaCl2溶液,看是否有白色沉淀生成;
(3)碳酸钠会与氯化钡生成碳酸钡沉淀和氯化钠,碳酸钠会与氯化钙反应生成碳酸钙沉淀和氯化钠,所以第④步操作加入过量的 Na2CO3目的是除去CaCl2、BaCl2,发生CaCl2+Na2CO3═CaCO3↓+2NaCl;BaCl2+Na2CO3═BaCO3↓+2NaCl,
故答案为:CaCl2;BaCl2;CaCl2+Na2CO3═CaCO3↓+2NaCl;BaCl2+Na2CO3═BaCO3↓+2NaCl;
(4)第④步操作后生成Mg (OH)2、CaCO3、BaCO3,如加入盐酸,都与盐酸反应,则沉淀溶解,故答案为:溶解Mg (OH)2、CaCO3、BaCO3.
点评 本题考查粗盐的提纯,为高考常见题型,侧重于学生的分析、实验能力的考查,把握流程中试剂的加入发生的化学反应及操作为解答的关键,注重实验的严密性和溶液的配制、物质提纯的考查,题目难度中等.


科目:高中化学 来源: 题型:解答题
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(NH3) | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
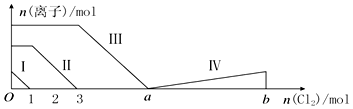
| A. | 线段Ⅱ表示Br-的变化情况 | |
| B. | 线段Ⅳ表示IO3-的变化情况,其中IO3-增加了5moL. | |
| C. | a=6 | |
| D. | 原溶液中n(FeI2):n(FeBr2)=3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
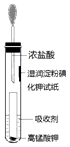 氯气贮运不方便,且具有一定的危险性,目前正逐渐被其他性能优越的消毒产品所替代.请回答:
氯气贮运不方便,且具有一定的危险性,目前正逐渐被其他性能优越的消毒产品所替代.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 对于C2H4 (g)+H2O(g)?C2H5OH(g),在一定条件下达到平衡状态时,体系的总压强为P,其中C2H4(g)、H2O(g)、C2H5OH(g)均为2 mol,则用分压表示的平衡常数Kp=$\frac{3}{P}$ | |
| B. | 恒温恒压下,在一容积可变的容器中,N2(g)+3H2(g)?2NH3(g)达到平衡状态时,N2、H2、NH3各1mol,若此时再充入3mol N2,则平衡正向移动 | |
| C. | 恒温恒压下,在一容积可变的容器中,反应2A(g)+B(g)?2C(g)达到平衡时,A、B和 C的物质的量分别为4mol、2mol和4mol,若此时A、B和C均减少1 mol,平衡逆向移动 | |
| D. | 对于一定条件下的某一可逆反应,用平衡浓度表示的平衡常数和用平衡分压表示的平衡常数,其数值不同,但意义相同,都只与温度有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ | B. | Na2O+H2O=2NaOH | ||
| C. | Na2CO3+2HCl=2NaCl+H2O+CO2↑ | D. | 4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$4NO2↑+O2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
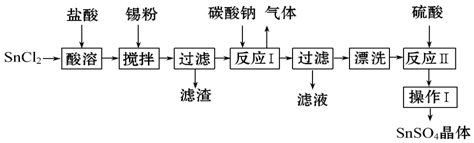
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
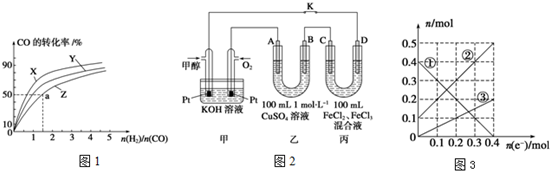
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com