
分析 反应中锌化合价变化为:0→+2,硝酸根中氮元素化合价变化为:+5→-3,依据氧化还原反应得失电子守恒结合原子个数守恒定律配平方程式.
解答 解:反应中锌化合价变化为:0→+2,硝酸根中氮元素化合价变化为:+5→-3,要使氧化还原反应得失电子守恒,则化合价变化最小公倍数为8,则锌的系数为4,硝酸根离子系数为1,依据原子个数守恒,氨根离子系数为1,锌离子系数为4,依据氧原子个数守恒可知,水分子系数为3,氢离子系数为10,方程式为:
Zn+10H++1NO3-═4Zn2++1NH4++3H2O;
故答案为:4;10;1;4;1;3.
点评 本题考查了氧化还原反应方程式书写,准确判断元素化合价变化、明确氧化还原反应得失电子守恒规律及原子个数守恒规律是解题关键,题目难度不大.


 星级口算天天练系列答案
星级口算天天练系列答案科目:高中化学 来源: 题型:选择题
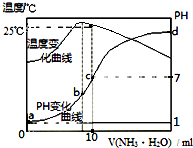
| A. | a点KW=1.0×10-14 | |
| B. | 水的电离程度:b>c>a>d | |
| C. | b点:c(NH4+)>c(Cl-)>c(H+)>c(OH-) | |
| D. | 25℃时,一水合氨的电离平衡常数为$\frac{1{0}^{-7}}{(10n-1)}$(用n表示) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴水、氯化铁溶液 | B. | 溴水、酸性高锰酸钾溶液 | ||
| C. | 溴水、碳酸钠溶液 | D. | 氯化铁溶液、酸性高锰酸钾溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
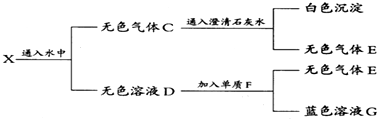
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 单质的氧化性:X<M | |
| B. | 气态氢化物的热稳定性:M>N | |
| C. | X与Y简单离子半径:r(X离子)<r(Y离子) | |
| D. | 化合物ZX2与ZN4含有相同类型的化学键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A,B,C的分子数之比为1:3:2 | |
| B. | C生成速率与A生成速率相等 | |
| C. | 单位时间内生成n molA同时3n mo1B | |
| D. | A,B、C的深度不再变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com