
| 鉴别方法 | Fe2+ | Fe3+ |
| 直接观察色 | 浅绿色 | 棕黄色 |
| 与KSCN溶液 | 无现象 | 血红色 |
| 金属 | Ti | Mg | Cu |
| 金属表面现象 | 放出气泡速度缓慢 | 放出气泡速度快 | 无变化 |
分析 (1)铁常见的化合价有+2价和+3价,根据化合价代数和为零判断;
(2)Fe2+溶液呈浅绿色,Fe3+溶液与KSCN溶液呈血红色;
(3)①与酸反应产生氢气,金属越活泼,产生氢气的速度越快;
②铜的活泼性比氢弱,不能与酸反应,镁可以与酸反应;
③Ti(钛)与盐酸反应生成氢气和钛离子,根据电荷守恒和元素守恒书写离子方程式;
④根据元素守恒,结合反应方程式TiO2+Cl2+2C═TiCl4+2X,可判断X的化学式;
解答 解:(1)铁常见的化合价有+2价和+3价,根据化合价代数和为零可知在Fe3O4中,有2个铁显+3价,一个铁显+2价,
故答案为:+2、+3;
(2)Fe2+溶液呈浅绿色,Fe3+溶液与KSCN溶液呈血红色,
故答案为:浅绿色;血红色;
(3)①与酸反应产生氢气,金属越活泼,产生氢气的速度越快,而铜与酸不反应是最不活泼的,所以三种金属的活泼性由强到弱的顺序是Mg、Ti、Cu,
故答案为:Mg、Ti、Cu;
②铜的活泼性比氢弱,不能与酸反应,镁可以与酸反应,所以可以用盐酸除去铜粉中的镁,
故答案为:盐酸;
③Ti(钛)与盐酸反应生成氢气和钛离子,反应的离子方程式为Ti+4H+═Ti4++2H2↑,
故答案为:Ti+4H+═Ti4++2H2↑;
④根据元素守恒,结合反应方程式TiO2+Cl2+2C═TiCl4+2X,可知X的化学式为CO,
故答案为:CO.
点评 本题以实验探究为载体考查金属活动性强弱顺序,为高频考点,侧重考查学生观察、分析、判断能力,熟练掌握金属活泼性强弱判断方法,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3mol/L | B. | 2mol/L | C. | 4mol/L | D. | 5mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 氟 | 氯 | 溴 | 碘 | |
| 第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
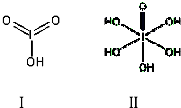
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铁及其化合物有重要用途,如聚合硫酸铁[Fe2(OH)n(SO4)3-n/2]m是一种新型高效的水处理混凝剂,而高铁酸钾(其中铁的化合价为+6)是一种重要的杀菌消毒剂,某课题小组设计如下方案制备上述两种产品:
铁及其化合物有重要用途,如聚合硫酸铁[Fe2(OH)n(SO4)3-n/2]m是一种新型高效的水处理混凝剂,而高铁酸钾(其中铁的化合价为+6)是一种重要的杀菌消毒剂,某课题小组设计如下方案制备上述两种产品:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④⑦⑧ | B. | ②③⑤⑦ | C. | ①②⑦⑧ | D. | ①④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 材料是为人类社会所需要并能用于制造有用器物的物质 | |
| B. | 人类使用和制造材料有悠久的历史,制造出的第一种材料是陶 | |
| C. | 体型结构的酚醛树脂制成的塑料,加工成型后,受热熔化后还可以制成其它形状的器物 | |
| D. | 高分子分离膜是具有传统高分子材料的机械性能,又具有特殊分离功能的功能高分子材料制成的薄膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用电解法精炼铜时粗铜作阴极 | |
| B. | 在其他条件不变时,增大压强一定会破坏气体反应的平衡状态 | |
| C. | 化学平衡常数K只与温度有关,与反应物浓度、体系的压强无关 | |
| D. | 需要加热的化学反应都是吸热反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com