
| |||||||||||||||
(1) |
答案:CH3COOH是共价化合物,体系中无自由移动的离子 精析:冰醋酸不导电是因为CH3COOH是共价化合物,体系中无自由移动的离子. |
(2) |
答案:b>a>c 精析:从导电能力上看,在b点导电能力最强,所以该点时溶液中自由移动的离子浓度最大,c(H+)显然也最大,pH最小,同理比较a点和c点导电能力,得出c(H+)在a点大于c点,pH则为a点小于c点,故三点溶液中pH是b<a<c. |
(3) |
答案:加较活泼的金属,加金属氧化物,加碱,加酸性较醋酸弱的弱酸盐,如Na2CO3 精析:要使c(CH3COO-)增大,而溶液的pH也增大,即c(H+)必须减小,只能是减小c(H+),使平衡向电离方向移动,采取的措施有:①加较活泼金属;②加金属氧化物;③加碱;④加酸性较醋酸弱的弱酸盐,如Na2CO3. 小结:理清导电性强弱和溶液中自由移动离子浓度的关系、c(H+)和pH大小的关系. |


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
 在一定温度下,冰醋酸加水稀释过程中溶液的导电能力如图所示,请回答:
在一定温度下,冰醋酸加水稀释过程中溶液的导电能力如图所示,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
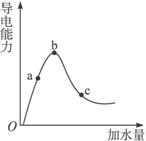
图3-2
(1)“O”点导电能力为零的理由是__________。
(2)a、b、c三点处,溶液的c(H+)由大到小的顺序为___________________。
(3)a、b、c三点处,电离程度最大的是_____________________。
(4)若使c点溶液中c(CH3COO-)增大,c(H+)减小,可采取的措施为:
①________。②________。
③________。④_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度下冰醋酸加水稀释的过程中,溶液的导电能力如图3-2所示,请完成下列问题:
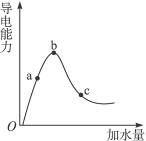
图3-2
(1)“O”点导电能力为零的理由是__________。
(2)a、b、c三点处,溶液的c(H+)由大到小的顺序为___________________。
(3)a、b、c三点处,电离程度最大的是_____________________。
(4)若使c点溶液中c(CH3COO-)增大,c(H+)减小,可采取的措施为:
①________。②________。
③________。④_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com