

分析 (1)根据Cr是24号元素,其原子核外有24个电子书写外围电子排布式;
(2)电子对给予-接受键被称为配位键;氢键是由已经与电负性很强的原子形成共价键的氢原子与另一个分子中电负性很强的原子之间的作用力,根据定义判断;
(3)根据价层电子对互斥理论、杂化轨道理论分析;
(4)根据其状态、熔点判断四羰基镍的晶体类型;根据相似相溶原理分析;
(5)元素X 位于第四周期,其基态原子的内层轨道全部排满电子,则内层电子数=2+8+18=28,且最外层电子数为2,所以该原子有30个电子,为Zn元素;元素Y最外层电子数是其内层的3倍,元素最外层电子数小于或等于8,则Y是O元素.
解答 解:(1)Cr是24号元素,其原子核外有24个电子,根据能量最低原理及洪特规则书写其核外电子排布式,3d能级的能量大于4s能级的能量,所以先排4s后排3d,轨道中的电子处于全满、半满、全空时原子最稳定,所以Cr的外围电子排布式为3d54s1,
故答案为:3d54s1;
(2)通过图象知,图中虚线表示的作用力有铜离子和水分子之间的配位键,氢原子和另一分子中氧原子之间的氢键,
故答案为:氢键、配位键;
(3)SO42一离子中含有4个δ键,孤电子对数=$\frac{6+2-4×2}{2}$=0,所以SO42一为正四面体结构;杂化轨道数=中心原子的孤电子对数+中心原子的δ键个数,所以采用sp3杂化,
故答案为:SO42一;sp3;
(4)Ni(CO)4是液态挥发性物质,所以其熔点较低,故为分子晶体;呈正四面体构型,是对称结构,所以是非极性物质,根据相似相溶原理知,Ni(CO)4 易溶于非极性溶剂,苯、四氯化碳是非极性物质,所以Ni(CO)4 易溶于苯、四氯化碳,
故答案为:分子晶体;BC;
(5)元素X 位于第四周期,其基态原子的内层轨道全部排满电子,则内层电子数=2+8+18=28,且最外层电子数为2,所以该原子有30个电子,为Zn元素;元素Y最外层电子数是其内层的3倍,元素最外层电子数小于或等于8,则Y是O元素,该晶胞中X离子数目=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,Y离子数目=4,所以X和Y离子数目之比等于4:4即1:1,所以该化合物的化学式为ZnO,故答案为:ZnO.
点评 本题考查较为综合,涉及电子排布式、分子的立体构型、杂化轨道类型、氢键、化学键类型等知识,具有一定的难度,本题注意Cr原子核外电子排布式中3d上5个电子4s上1个电子,不是3d上4个电子4s上2个电子,要注意Cr、Cu原子核外电子排布式的书写.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 电解池的阳极,原电池负极都发生还原反应 | |
| B. | 不能自发进行的氧化还原反应,通过电解的原理可以实现 | |
| C. | 原电池的两极,一定要由活泼性不同的两种金属组成 | |
| D. | 电解池中阳离子移向阴极,原电池中阳离子移向负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通入Cl2后,溶液变为黄色,加淀粉液后溶液变蓝,则原溶液中一定有I- | |
| B. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,则原溶液中一定有SO42- | |
| C. | 加入稀盐酸产生无色无味气体,将气体通入澄清石灰水中,溶液变浑浊,则原溶液中一定有CO32- | |
| D. | 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3p3表示3p能级有三个轨道 | |
| B. | 基态碳原子的价电子排布图: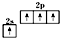 | |
| C. | 冰和固体碘晶体中相互作用力不完全相同 | |
| D. | 某气态团簇分子结构如图所示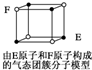 ,该气态团簇分子的分子式为EF或FE ,该气态团簇分子的分子式为EF或FE |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
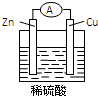 Zn-Cu-H2SO4原电池的负极材料是Zn,正极反应式是2H++2e-═H2↑,发生还原反应反应(填反应类型),总反应式为Zn+H2SO4═ZnSO4+H2↑.
Zn-Cu-H2SO4原电池的负极材料是Zn,正极反应式是2H++2e-═H2↑,发生还原反应反应(填反应类型),总反应式为Zn+H2SO4═ZnSO4+H2↑.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .用系统法命名为:2-甲基丁烷.
.用系统法命名为:2-甲基丁烷.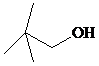 ,其名称(系统法命名)为2,2-二甲基-1-丙醇,1mol醇A与足量钠反应,可生成H2的体积为11.2L(标况)
,其名称(系统法命名)为2,2-二甲基-1-丙醇,1mol醇A与足量钠反应,可生成H2的体积为11.2L(标况)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 推广使用太阳能、风能、海洋能、氢能,有利于缓解温室效应 | |
| B. | 乙醇和汽油都是可再生能源,应大力推广“乙醇汽油” | |
| C. | 普通锌锰干电池不含环境污染物,用完后可以随意扔掉,使用方便 | |
| D. | 燃料电池是利用燃料燃烧,将化学能转化为热能,然后再转化为电能的化学电源 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
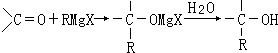

 ,
,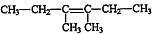 ;
;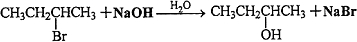 ,I→J
,I→J .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com