
A.c(Na+)>c(CH3COO-)>c(OH-)>c(H+) B.c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
C.c(Na+)>c(OH-)>c(H+)>c(CH3COO-) D.c(Na+)>c(OH-)=c(CH3COO-)>c(H+)
科目:高中化学 来源: 题型:阅读理解
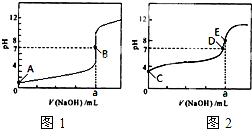
查看答案和解析>>
科目:高中化学 来源: 题型:
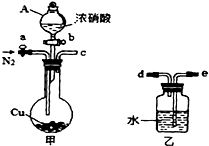 (2012?宁德模拟)某化学课外小组利用如图实验装置(夹持仪器略去),探究铜与浓硝酸反应是否有NO生成.
(2012?宁德模拟)某化学课外小组利用如图实验装置(夹持仪器略去),探究铜与浓硝酸反应是否有NO生成.查看答案和解析>>
科目:高中化学 来源: 题型:
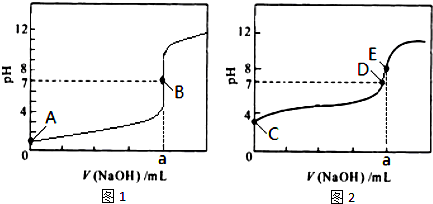
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 实验编号 | 盐酸体积( mL ) | 标准NaOH溶液的体积(mL) |
| 1 | 20.00 | 18.20 |
| 2 | 17.10 | |
| 3 | 16.90 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com