
 ������Ҫ�ĵ��ʣ��ϳ�ԭ��Ϊ��N2��g��+3H2��g��
������Ҫ�ĵ��ʣ��ϳ�ԭ��Ϊ��N2��g��+3H2��g�� | ��ѹ |
| ���� |
| C2(NH3) |
| C(N2)C3(H2) |
| C2(NH3) |
| C(N2)C3(H2) |
(
| ||||
(
|
(
| ||||
(
|
| ��n | ||
|
| ��ѹ |
| ���� |
| C2(NH3) |
| C(N2)C3(H2) |
| C2(NH3) |
| C(N2)C3(H2) |
| ��n | ||
|
| (0.1-0)mol | ||
|
| C2(NH3) |
| C(N2)C3(H2) |
(
| ||||
(
|
| 2.5mol |
| 2.5mol+2.25mol+0.75mol |
(
| ||||
(
|


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
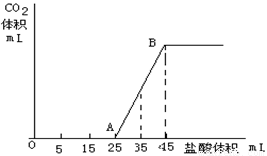
��һ�� ��2��5g̼���ơ�̼�����ƺ��������ƹ���������ȫ�ܽ���ˮ���Ƴ�ϡ��Һ��Ȼ�������Һ����μ���1mol/L�����ᣬ�������������������CO2���������״������ϵ����ͼ��ʾ��

��1��д��OA����������Ӧ�����ӷ���ʽ
��2��������35mL����ʱ������������̼�����Ϊ mL����״����
��3��ԭ�������Na2CO3����������Ϊ???? ��
��������������Ҫ�ĵ��ʣ��Dz������Ļ�����Ʒ֮һ���α�����ܵĺϳɰ������й��������ǵ¹���ѧ�ҹ�����1905�귢���ģ���ϳ�ԭ��Ϊ��N2(g) + 3H2(g)![]() 2NH3(g)��
2NH3(g)��
��H���D92.4 kJ/mol������˻����1918���ŵ������ѧ�����Իش��������⣺
�� ���з������ʺ�ʵ������ȡ�������� ������ţ���
A������ʯ���е���Ũ��ˮ B������Ũ��ˮ
C��ֱ���������͵����ϳ� D�����Ȼ����Һ�е���Ũ����������Һ
�� �ϳɰ���ҵ�в�ȡ�����д�ʩ������������ԭ�����͵��� ������ţ���
A�����ýϸ�ѹǿ��20 M Pa��50 M Pa��
B������500��ĸ���
C��������ý������
D�������ɵİ�Һ������ʱ����ϵ�з��������δ��Ӧ��N2��H2ѭ�����ϳ�����
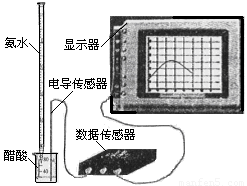
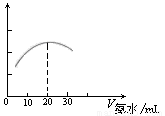
��3�� �����ֻ���ϢϵͳDIS������ͼ����ʾ�����ɴ����������ݲɼ����ͼ������ɣ����Բⶨ������ˮ��Ũ�ȡ�����ʽ�ζ���ȷ��ȡ0.5000 mol/L������Һ25.00 mL���ձ��У��Ը��ְ�ˮ���еζ����������Ļ����ʾ����Һ���������氱ˮ����仯����������ͼ����ʾ��


ͼ�� ͼ��
�� �õζ���ʢ��ˮǰ���ζ���Ҫ�� ��ϴ2��3�飬
�� �Լ�����ְ�ˮ��Ũ�ȣ� ��
�� ��������£��ᵼ��ʵ����c(NH3��H2O)ƫ�͵��� ��
A���ζ�����ʱ���Ӷ���
B����ȡ25.00 mL������Һʱ��δ����ʢ��Һ��ϴ�ζ���
C���ζ�ʱ����������ˮ�����ձ���
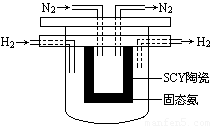
��4�� 1998��ϣ������ʿ��´�ѧ��Marnellos��Stoukides���ø����ӵ����Ե�SCY�մɣ��ܴ���H+����ʵ���˸��³�ѹ�¸�ת���ʵĵ绯ѧ�ϳɰ�����ʵ��װ������ͼ��

�����ĵ缫��ӦʽΪ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
��һ����6�֣� ��2��5g̼���ơ�̼�����ƺ��������ƹ���������ȫ�ܽ���ˮ���Ƴ�ϡ��Һ��Ȼ�������Һ����μ���1mol/L�����ᣬ�������������������CO2���������״������ϵ����ͼ��ʾ��
��1��д��OA����������Ӧ�����ӷ���ʽ
��2��������35mL����ʱ������������̼�����Ϊ mL����״����
��3��ԭ�������Na2CO3����������Ϊ ��
��������������Ҫ�ĵ��ʣ��Dz������Ļ�����Ʒ֮һ���α�����ܵĺϳɰ������й��������ǵ¹���ѧ�ҹ�����1905�귢���ģ���ϳ�ԭ��Ϊ��N2(g) + 3H2(g)![]() 2NH3(g)��
2NH3(g)��
��H���D92.4 kJ/mol������˻����1918���ŵ������ѧ�����Իش��������⣺
�� ���з������ʺ�ʵ������ȡ�������� ������ţ���
A������ʯ���е���Ũ��ˮ B������Ũ��ˮ
C��ֱ���������͵����ϳ� D�����Ȼ����Һ�е���Ũ����������Һ
�� �ϳɰ���ҵ�в�ȡ�����д�ʩ������������ԭ�����͵��� ������ţ���
A�����ýϸ�ѹǿ��20 M Pa��50 M Pa��
B������500��ĸ���
C��������ý������
D�������ɵİ�Һ������ʱ����ϵ�з��������δ��Ӧ��N2��H2ѭ�����ϳ�����
��3�� �����ֻ���ϢϵͳDIS������ͼ����ʾ�����ɴ����������ݲɼ����ͼ������ɣ����Բⶨ������ˮ��Ũ�ȡ�����ʽ�ζ���ȷ��ȡ0.5000 mol/L������Һ25.00 mL���ձ��У��Ը��ְ�ˮ���еζ����������Ļ����ʾ����Һ���������氱ˮ����仯����������ͼ����ʾ��


ͼ�� ͼ��
�� �õζ���ʢ��ˮǰ���ζ���Ҫ�� ��ϴ2��3�飬
�� �Լ�����ְ�ˮ��Ũ�ȣ� ��
�� ��������£��ᵼ��ʵ����c(NH3��H2O)ƫ�͵��� ��
A���ζ�����ʱ���Ӷ���
B����ȡ25.00 mL������Һʱ��δ����ʢ��Һ��ϴ�ζ���
C���ζ�ʱ����������ˮ�����ձ���
��4�� 1998��ϣ������ʿ��´�ѧ��Marnellos��Stoukides���ø����ӵ����Ե�SCY�մɣ��ܴ���H+����ʵ���˸��³�ѹ�¸�ת���ʵĵ绯ѧ�ϳɰ�����ʵ��װ������ͼ��

�����ĵ缫��ӦʽΪ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2010-2011ѧ��ӱ�ʡ������ѧ�ڵ�һ�ε��п��ԣ����ۣ���ѧ���� ���ͣ������
��һ����6�֣� ��2��5g̼���ơ�̼�����ƺ��������ƹ���������ȫ�ܽ���ˮ���Ƴ�ϡ��Һ��Ȼ�������Һ����μ���1mol/L�����ᣬ�������������������CO2���������״������ϵ����ͼ��ʾ��
��1��д��OA����������Ӧ�����ӷ���ʽ
��2��������35mL����ʱ������������̼�����Ϊ mL����״����
��3��ԭ�������Na2CO3����������Ϊ ��
��������������Ҫ�ĵ��ʣ��Dz������Ļ�����Ʒ֮һ���α�����ܵĺϳɰ������й��������ǵ¹���ѧ�ҹ�����1905�귢���ģ���ϳ�ԭ��Ϊ��N2(g) + 3H2(g) 2NH3(g)��
2NH3(g)��
��H���D92.4 kJ/mol������˻����1918���ŵ������ѧ�����Իش��������⣺
�� ���з������ʺ�ʵ������ȡ�������� ������ţ���
A������ʯ���е���Ũ��ˮ B������Ũ��ˮ
C��ֱ���������͵����ϳ� D�����Ȼ����Һ�е���Ũ����������Һ
�� �ϳɰ���ҵ�в�ȡ�����д�ʩ������������ԭ�����͵��� ������ţ���
A�����ýϸ�ѹǿ��20 M Pa��50 M Pa��
B������500��ĸ���
C��������ý������
D�������ɵİ�Һ������ʱ����ϵ�з��������δ��Ӧ��N2��H2ѭ�����ϳ�����
��3�� �����ֻ���ϢϵͳDIS������ͼ����ʾ�����ɴ����������ݲɼ����ͼ������ɣ����Բⶨ������ˮ��Ũ�ȡ�����ʽ�ζ���ȷ��ȡ0.5000 mol/L������Һ25.00 mL���ձ��У��Ը��ְ�ˮ���еζ����������Ļ����ʾ����Һ���������氱ˮ����仯����������ͼ����ʾ��
ͼ�� ͼ��
�� �õζ���ʢ��ˮǰ���ζ���Ҫ�� ��ϴ2��3�飬
�� �Լ�����ְ�ˮ��Ũ�ȣ� ��
�� ��������£��ᵼ��ʵ����c(NH3��H2O)ƫ�͵��� ��
A���ζ�����ʱ���Ӷ���
B����ȡ25.00 mL������Һʱ��δ����ʢ��Һ��ϴ�ζ���
C���ζ�ʱ����������ˮ�����ձ���
��4�� 1998��ϣ������ʿ��´�ѧ��Marnellos��Stoukides���ø����ӵ����Ե�SCY�մɣ��ܴ���H+����ʵ���˸��³�ѹ�¸�ת���ʵĵ绯ѧ�ϳɰ�����ʵ��װ������ͼ��
�����ĵ缫��ӦʽΪ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
������Ҫ�ĵ��ʣ��Dz������Ļ�����Ʒ֮һ���α�����ܵĺϳɰ������й��������ǵ¹���ѧ�ҹ�����1905�귢���ģ���ϳ�ԭ��Ϊ��N2(g) + 3H2(g)![]() 2NH3(g)��
2NH3(g)��
��H���D92.4 kJ/mol������˻����1918���ŵ������ѧ�����Իش��������⣺
�� ���з������ʺ�ʵ������ȡ�������������������� ������ţ���
A������ʯ���е���Ũ��ˮ������ B������Ũ��ˮ
C��ֱ���������͵����ϳɡ����� D�����Ȼ����Һ�е���Ũ����������Һ
�� �ϳɰ���ҵ�в�ȡ�����д�ʩ������������ԭ�����͵��������� ������ţ���
A�����ýϸ�ѹǿ��20 M Pa��50 M Pa��
B������500��ĸ��¡�
C��������ý������
D�������ɵİ�Һ������ʱ����ϵ�з��������δ��Ӧ��N2��H2ѭ�����ϳ�����
��3�� �����ֻ���ϢϵͳDIS������ͼ����ʾ�����ɴ����������ݲɼ����ͼ������ɣ����Բⶨ������ˮ��Ũ�ȡ�����ʽ�ζ���ȷ��ȡ0.5000 mol/L������Һ25.00 mL���ձ��У��Ը��ְ�ˮ���еζ����������Ļ����ʾ����Һ���������氱ˮ����仯����������ͼ����ʾ��
 ��������
�������� 
ͼ���� ��������������������������ͼ��
�� �õζ���ʢ��ˮǰ���ζ���Ҫ���������������������������� ��ϴ2��3�飬
�� �Լ�����ְ�ˮ��Ũ�ȣ����������������������� ��
�� ��������£��ᵼ��ʵ����c(NH3��H2O)ƫ�͵����������������� ��
A���ζ�����ʱ���Ӷ���
B����ȡ25.00 mL������Һʱ��δ����ʢ��Һ��ϴ�ζ���
C���ζ�ʱ����������ˮ�����ձ���
��4�� 1998��ϣ������ʿ��´�ѧ��Marnellos��Stoukides���ø����ӵ����Ե�SCY�մɣ��ܴ���H+����ʵ���˸��³�ѹ�¸�ת���ʵĵ绯ѧ�ϳɰ�����ʵ��װ������ͼ��

�����ĵ缫��ӦʽΪ������������������������������������������ ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com