(2008?郑州一模)某一反应体系中存在以下五种物质:Na
3AsO
3、H
2O、I
2、Na
3AsO
4、HI
(1)若水是产物,试用这五种物质组成一个合理的反应方程式,配平并标出电子转移的方向和数目:
;
(2)当pH为5~9时,该反应体系中的氧化反应为由HI→I
2;当pH<4时,反应向逆反应方向进行,此时体系中的氧化反应为由
Na3AsO3
Na3AsO3
→
Na3AsO4
Na3AsO4
.如果两种情况下反应中转移电子数相等,则两个反应中氧化剂的物质的量之比是
1:1
1:1
;
(3)物质的氧化性和还原性不仅与溶液的酸碱性有关,还与物质的浓度和反应温度等因素有关.下列各组物质由于浓度不同而发生不同氧化还原反应的是(填序号)
①④
①④
.
①Cu与HNO
3溶液 ②Cu与FeCl
3溶液 ③Fe与HCl溶液 ④Zn与H
2SO
4溶液.

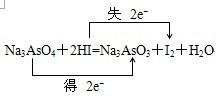

 ;
;

 备战中考寒假系列答案
备战中考寒假系列答案