
有A、B、C三种电解质溶液分别装在三个烧杯中,插有石墨电极,并按下图所示方式在电路中连接。闭合开关K后,测得各支路电流强度I1≈IⅡ(其中IⅡ 略小)。若撤去B,测知电流强度IA《Ic;若撒去C,并将A、B两溶液混匀后均分为 两等份,再重置于电路I、Ⅱ处,测知通过A、B混合溶液的电流强度与先前通过A 溶液的电流强度的相对大小关系为:1AB》IA。已知A、B、C分别选自下列溶液:0.1mol·L-1盐酸、0.1mol·L-1醋酸、0.1mol·L-1NaCl 溶液、0.1mol·L-1硫酸、0.1mol·L-1NaOH溶液、 0.1mol·L-1氨水,且25℃时A溶液PH<7。
(1)指出A、B、C是(或可能是)什么溶液?A________; B________;C________。
(2)若向C溶液中滴入酚酞试剂呈红色,则C是________;将A、B、C分别以等体 积进行两两混合,结果是哪种组合的混合液中,水的电离度最大?(填“A”“B”或“C”)。
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||

查看答案和解析>>
科目:高中化学 来源: 题型:

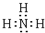
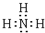
查看答案和解析>>
科目:高中化学 来源: 题型:
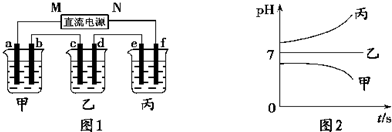
有A、B、C三种短周期元素,它们的原子序数依次增大,B元素原子最外层电子数是C元素原子最外层电子数的一半,A元素原子最外层电子数比B元素原子最外层电子数多一个。甲、乙、丙依次是A、B、C三元素最高价含氧酸的钠盐,甲、乙溶液pH>7,丙溶液pH<7;丁为气体,戊为淡黄色固体。甲、乙、丙、丁、戊、己六种物质之间的相互反应关系如下图(部分产物已略去):
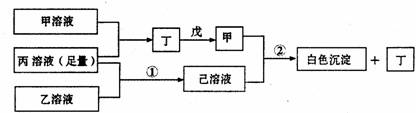
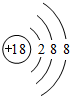
(1)A的元素名称为 ,C元素的简单离子结构示意图为 ;
(2)写出反应①的离子方程式 ;
(3)甲溶液中所有离子的浓度由大到小的顺序为 ;
(4)将两个铜电极插入丙溶液中进行电解,开始时发生的离子方程式为 ;
(5)写出反应②的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
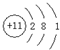
有A、B、C三种硝酸盐和一种钠盐D。A和B中的金属元素为同族,A和D的水溶液混合可生成黄色沉淀,B和D的水溶液混合可生成白色沉淀,C和D的水溶液混合可生成黑色沉淀,在C的溶液中加入强碱立即析出白色胶状沉淀,该沉淀溶于过量的强碱中。用铂作阳极,铜作阴极,电解D的溶液,在阳极上析出黄色沉淀。
①写出A、B、C、D的分子式。(2分)
②写出A、B、C与D的溶液反应的离子方程式。(3分)
③写出C与强碱溶液反应的离子方程式。(2分)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com