
镁一过氧化氢燃料电池具有比能量高、安全方便等优点,其总反应为Mg+H2O2+H2SO4=MgSO4+2H2O,结构示意图如图所示。下列关于该电池的叙述正确的是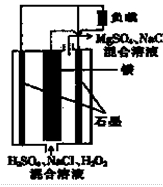
A.电池内部可以使用MnO2作填料
B.电流工作时,H+向Mg电极移动
C电池工作时,正极的电板反应式为Mg—2e— Mg2+
D.电池工作时,电解质溶液的pH将不断变大
科目:高中化学 来源: 题型:单选题
在下列装置中,MSO4和NSO4是两种常见金属的易溶盐。当K闭合时,SO42-从右到左通过交换膜移向M极,下列分析正确的是( )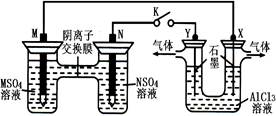
| A.溶液中c(M2+)减小 |
| B.N的电极反应式:N-2e-=N2+ |
| C.X电极上有H2产生,发生还原反应 |
| D.反应过程中Y电极周围生成白色胶状沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
关于如图所示装置的叙述正确的是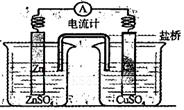
| A.铜是阳极,铜片上有气泡产生 |
| B.铜离子在铜片表面被氧化 |
| C.电子从锌片经外电路流向铜片 |
| D.正极附近的SO42-离子浓度逐渐增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
pH=a某电解质溶液中,插入两支惰性电极通直流电一段时间后,溶液的pH<a,则该电解质可能是
| A.Ba(OH)2 | B.HCl | C.Na2SO4 | D.AgNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
氢镍电池是一种碱性可充电电池,污染小,比能量较大。氢镍电池的总反应式是:
H2+2NiO(OH) 2Ni(OH)2。据此反应式判断,下列叙述中正确的是
2Ni(OH)2。据此反应式判断,下列叙述中正确的是
| A.电池放电时,H2是正极 |
| B.电池充电时,镍元素被还原 |
| C.充电时,电池负极的电极反应式为2H2O+2e—=H2+2OH— |
| D.电池放电时,H2是负极,负极周围溶液的pH不断增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆圈中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示。导致该现象的主要原因是液滴之下氧气含量比边缘少。下列说法正确的是( )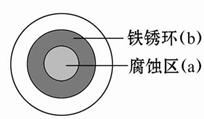
| A.液滴中的Cl-由a区向b区迁移 |
| B.液滴边缘是正极区,发生的电极反应为O2+2H2O+4e-=4OH- |
| C.液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a区向b区迁移,与b区的OH-形成Fe(OH)2,进一步氧化、脱水形成铁锈 |
| D.若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶液,则负极发生的电极反应为Cu-2e-=Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
研究人员最近发明了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl。下列“水”电池在海水中放电时的有关说法正确的是( )
| A.正极反应式:Ag+Cl--e-=AgCl |
| B.每生成1 mol Na2Mn5O10转移2 mol电子 |
| C.Na+不断向“水”电池的负极移动 |
| D.AgCl是还原产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
如图所示,?为直流电源,?为浸透饱和氯化钠溶液和酚酞试液的滤纸,?为电镀槽。接通电路(未闭合K)后发现?上的c点显红色。为实现铁片上镀铜,接通K后,使c、d两点短路。下列叙述不正确的是 ( )。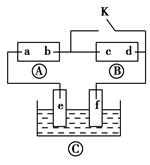
| A.b为直流电源的负极 |
| B.f极为阴极,发生还原反应 |
| C.e极材料为铁片,f极材料为铜片 |
| D.可选用CuSO4溶液或CuCl2溶液作电镀液 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
甲图为一种新型污水处理装置,该装置可利用一种微生物将有机废水的化学能直接转化为电能。乙图是一种家用环保型消毒液发生器,用惰性电极电解饱和食盐水。下列说法中不正确的是 ( )。
| A.装置乙的a极要与装置甲的X极连接 |
| B.装置乙中b极的电极反应式为2Cl--2e-=Cl2↑ |
| C.若有机废水中主要含有葡萄糖,则装置甲中M极发生的电极应为C6H12O6+6H2O-24e-=6CO2↑+24H+ |
| D.N电极发生还原反应,当N电极消耗5.6 L(标准状况下)气体时,则有2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com