

| A、200℃时,反应从开始到平衡的平均速率v(B)=0.04mol?L-1?min-1 |
| B、图Ⅱ所知反应xA(g)+yB(g)?zC(g)的△H<0,且a=2 |
| C、若在图Ⅰ所示的平衡状态下,再向体系中充入He,重新达到平衡前v(正)>v(逆) |
| D、200℃时,向容器中充入2 mol A 和1 mol B,达到平衡时,A 的体积分数小于50% |
| ||
| △t |
| ||
| 5min |
| 0.4mol |
| 0.4mol+0.2mol+0.2m0l |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
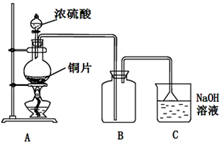 I.Fe2+和I-是两种常见的还原性离子.
I.Fe2+和I-是两种常见的还原性离子.| 实验步骤 | 预期现象与结论 |
| 步骤1:取2mL FeSO4溶液和2mL KI溶液混合于试管中,再滴加1~2滴氯水. | 溶液变成黄色 |
| 步骤2: |
| 序号 | 不合理的原因 | 误差 (偏低或偏高) |
改变措施 |
| 方案① | |||
| 方案② |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、只有②③ |
| B、只有②③⑤ |
| C、只有①②③④ |
| D、①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、正极反应式为:O2+2H2O+4e-=4OH- |
| B、工作一段时间后,电解液中KOH的物质的量不变 |
| C、该燃料电池的总反应方程式为:2H2+O2=2H2O |
| D、用其作电源电解精炼铜时,纯铜作阳极,而在镀件上电镀铜时金属铜作阴极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
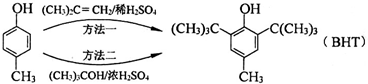
A、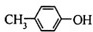 与BHT为同系物 与BHT为同系物 |
B、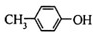 能发生氧化反应 能发生氧化反应 |
| C、BHT不能与NaHCO3溶液反应生成CO2 |
| D、两种方法的反应类型都是加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
60 27 |
60 27 |
| A、是一种核素 | ||
| B、质子数是60 | ||
C、与
| ||
| D、中子数是33 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 5 |
| 4 |
| 1 |
| 4 |
| 5 |
| 4 |
| 1 |
| 4 |
| A、由白磷变红磷是吸热反应 |
| B、白磷、红磷都是磷的单质,相互可以自由转化,不吸热,也不放热 |
| C、等质量时,白磷比红磷具有的能量高 |
| D、等物质的量时,断白磷分子中的键比断红磷分子中的键消耗的能量多 |
查看答案和解析>>
科目:高中化学 来源: 题型:
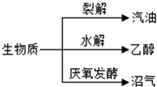 生物质(通过光合作用产生的有机体)是一种可再生能源,能发生如图转化.下列说法不正确的是( )
生物质(通过光合作用产生的有机体)是一种可再生能源,能发生如图转化.下列说法不正确的是( )| A、沼气的主要成分是甲烷 |
| B、汽油属于一次能源 |
| C、乙醇属于可再生能源 |
| D、生物质能来源于太阳能 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、除去氨气中的水蒸气:气体通过装有浓硫酸的洗气瓶 |
| B、除去CO2中少量的SO2:气体通过盛饱和碳酸钠溶液的洗气瓶 |
| C、除去FeCl2溶液中混有的FeCl3:加入过量铁粉,过滤 |
| D、除去Cu粉中混有的CuO:加适量稀硝酸后,过滤.洗涤 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com