
��֪A��B��C��D��E�Ƕ�������ԭ���������������5������Ԫ�أ�����Ԫ��A��E�ĵ����ڳ����³���̬��Ԫ��B��ԭ������������������Ӳ�����2����Ԫ��C��ͬ���ڵ�����Ԫ���� ԭ�Ӱ뾶���Ԫ��D��
ԭ�Ӱ뾶���Ԫ��D�� �Ͻ����ճ������г��õĽ������ϡ�����˵����ȷ����
�Ͻ����ճ������г��õĽ������ϡ�����˵����ȷ����
A��Ԫ��A��B��ɵĻ����ﳣ����һ������̬
B��Ԫ ��C��D������������Ӧ��ˮ����֮�䲻�ܷ�����Ӧ
��C��D������������Ӧ��ˮ����֮�䲻�ܷ�����Ӧ
C����ҵ�ϳ��õ�ⷨ�Ʊ�Ԫ��C��D��E�ĵ���
D��������AE��CE������ͬ���͵Ļ�ѧ��
C
��������
���������Ԫ��B��ԭ������������������Ӳ�����2��������B��ԭ�������Ĺ�ϵ����֪B��2����ӣ��������4�����ӣ�����B��CԪ�أ�Ԫ��C��ͬ���ڵ�����Ԫ���� ԭ�Ӱ뾶�����C�ǵ�������Ԫ��Na��Ԫ��D��
ԭ�Ӱ뾶�����C�ǵ�������Ԫ��Na��Ԫ��D�� �Ͻ����ճ������г��õĽ������ϣ���D��AlԪ�أ�Ԫ��A��E�ĵ����ڳ����³���̬������A��HԪ�أ�E��ClԪ�أ�����������Ϊ���塣A��H��CԪ���γɵĻ����ﲻһ������̬������B���Ƶ�����������ˮ�������������ƣ�Al������������ˮ�������������������߿��Է�����Ӧ������C����ҵ���õ�������Ȼ��ơ���������ʳ��ˮ�ķ����ֱ���ȡNa��Al������������ȷ��D��HCl�����к��й��ۼ�����NaCl�������Ӽ�����ѧ�����Ͳ�ͬ������ѡC��
�Ͻ����ճ������г��õĽ������ϣ���D��AlԪ�أ�Ԫ��A��E�ĵ����ڳ����³���̬������A��HԪ�أ�E��ClԪ�أ�����������Ϊ���塣A��H��CԪ���γɵĻ����ﲻһ������̬������B���Ƶ�����������ˮ�������������ƣ�Al������������ˮ�������������������߿��Է�����Ӧ������C����ҵ���õ�������Ȼ��ơ���������ʳ��ˮ�ķ����ֱ���ȡNa��Al������������ȷ��D��HCl�����к��й��ۼ�����NaCl�������Ӽ�����ѧ�����Ͳ�ͬ������ѡC��
���㣺����Ԫ�ص��ƶϣ����������ʵ��ж�


 ������������Ӧ����ϵ�д�
������������Ӧ����ϵ�д� ͬ����չ�Ķ�ϵ�д�
ͬ����չ�Ķ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2014-2015����ʡ��һ��ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
���������ʳ�û����ͻ��н϶��ˮ�ݣ��㽫�������к��ַ�������
A������ B������ C����Һ D����ȡ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015�ӱ�ʡ�߶���ѧ�ڵ������¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
��ͼ��ʾ�ס�������װ�ã���ʢ��Һ�����Ũ�Ⱦ���ͬ������������װ�õ�·��ͨ���ĵ��Ӷ���1 molʱ������˵������ȷ����
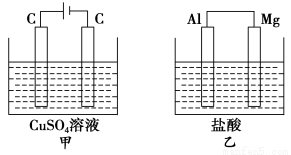
A����Һ�������仯����С������
B����ҺpH�仯����С������
C����ͬ�����²�������������V�ף�V��
D���缫��Ӧʽ����������ΪCu2����2e��===Cu�����и���ΪMg��2e��===Mg2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�긣��ʡ������ѧ�ڵ��Ĵ��¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
�����£���������NaHCO3��Һ��Ӧ���������������
A���� B���� C���� D��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�긣��ʡ������ѧ�ڵ��Ĵ��¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
Al��Fe��Cu������Ҫ�Ľ���Ԫ�أ�����˵����ȷ����
A�����߶�Ӧ���������Ϊ����������
B�����ߵĵ��ʷ����ڿ����о�ֻ����������
C���� ��AlCl3��FeCl3��CuCl2��������ܲ��ý���Һ
��AlCl3��FeCl3��CuCl2��������ܲ��ý���Һ ֱ�����ɵķ���
ֱ�����ɵķ���
D�����AlCl3��FeCl3��CuCl2 �Ļ����Һʱ��������������Cu��Fe��Al
�Ļ����Һʱ��������������Cu��Fe��Al
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�긣��ʡ������ѧ�ڵ��Ĵ��¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
���й����л����������ȷ����
A�����顢��ϩ�ͱ�����ͨ��ʯ�ͷ���õ�
B���������ϩ�ֱ���Cl2��Ӧ���ж�����������
C����ȩ������(NH4)2SO4��Һ����ʹ�����ʷ�������
D���۱�ϩ�Ľṹ��ʽΪ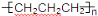
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�����������и�����ѧ�ڵ������¿������Ծ��������棩 ���ͣ������
(14��)������Ϊһ���ִ���ͨ�������ڽ���ǧ��������β���к���CO��NOx���ж����壬����Ⱦ����Ҳ��Ϊ������ἱ���������⡣
��1����������������ʱ������N2��O2��Ӧ���������仯ʾ��ͼ��ͼ��
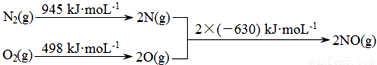
��÷�Ӧ���Ȼ�ѧ����ʽΪ ��
��2����������װβ������װ�ã���ʹCO��NOx�ж��������Ӧת��Ϊ�����塣
2xCO��2NOx == 2xCO2��N2����ת�Ƶ������ʵ���Ϊ0.4x molʱ���÷�Ӧ���ɱ�״���µ�N2��� L��
��3��һ����̼��һ����;�൱�㷺�Ļ�������ԭ�ϡ����Ի�ԭ��������������������ϳɺܶ��л�����״��ȡ���ѹǿΪ0.1 MPa�����£���a mol CO��3a mol H2�Ļ�������ڴ��������·�Ӧ���ɼ״��� CO(g)��2H2(g)  CH3OH(g)����H�� -b kJ?mol-1
CH3OH(g)����H�� -b kJ?mol-1
�ٸ÷�Ӧ��ƽ�ⳣ������ʽΪ ��
���������ݻ����䣬���д�ʩ�����Ӽ״����ʵ��� ��
A�������¶� B����CH3OH(g)����ϵ�з���
C������He��ʹ��ϵ��ѹǿ���� D���ٳ���1 mol CO��3 mol H2
�۾��ⶨ��ͬ�¶��¸÷�Ӧ��ƽ�ⳣ�����£�
�¶ȣ��棩 | 250 | 300 | 350 |
K | 2.041 | 0.270 | 0.012 |
��ijʱ�̡�250���ø÷�Ӧ�ķ�Ӧ�����������Ũ��Ϊc(CO) ��0.4 mol/L��c(H2)��0.4 mol/L��c(CH3OH)��0.8 mol��L��1, ���ʱv�� v��(�������)��
��4���״�����Ҫ�Ļ�������ԭ�ϣ�����һ�����͵�ȼ�ϣ��������������һ��ȼ�ϵ�أ�һ���缫ͨ���������һ���缫����״�����صĵ�����Dz�����Y2O3��ZrO2���壬���ڸ������ܴ���O2-���ӡ��õ�ص�������ӦʽΪ_____________________________����ع���ʱ�������������O2-��_______���ƶ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ���㽭ʡ������ѧ��10���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
����˵����ȷ����
A����֪ ����Լ���CH3��CH3 �� CH2��CH2��H2����H =��125.6 kJ/mol
����Լ���CH3��CH3 �� CH2��CH2��H2����H =��125.6 kJ/mol
B����˵��NH3���H+������H2Oǿ��NH3+H3O+=NH+4+H2O
C����֪�����Ȼ�ѧ����ʽ��2H2(g)+O2(g) === 2H2O(g) ��H����484kJ/mol����������ȼ����Ϊ��242kJ/mol
D����֪�к���Ϊ��57.4kJ/mol ����NaOH��aq�� ��CH3COOH��aq����CH3COONa��aq����H2O��l������H ����57.4kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ��ɽ��ʡ�����и���12��У�����ϼ�⻯ѧ�Ծ��������棩 ���ͣ�ѡ����
����Cu2O���ھ��������Ĵ����ܶ��ܵ���ע���������ӽ���Ĥ���Ƶ��Һ��OHһ��Ũ���Ʊ�����Cu2O��װ����ͼ��ʾ�������ķ�ӦΪ��2Cu+H2O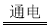 Cu2O+H2��������˵����ȷ����
Cu2O+H2��������˵����ȷ����
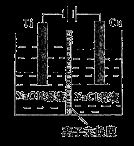
A���ѵ缫����������Ӧ
B������������Һ��pH������
C�����ӽ���ĤӦ�������������ӽ���Ĥ
D��������Ӧʽ�ǣ�2Cu+2OHһһ2eһ== Cu2O+H2O
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com