
【题目】向火箭燃料液态联氨(N2H4)中加入催化剂,发生反应:N2H4(l)=N2(g)+2H2(g) △H。
已知: ①3N2H4(l)=4NH3(g)+ N2(g) △H1=-336.6kJ·mol-1
②N2(g)+3H2(g) ![]() 2NH3(g)△H2=-92.4kJ·mol-1。
2NH3(g)△H2=-92.4kJ·mol-1。
下列说法错误的是
A. 使用催化剂后,反应②的正、逆反应的活化能都减小,但△H1不变
B. △H=-151.8kJ·mol-1
C. 将28g N2和10mol H2混合充分反应,放出的热量一定小于92.4 kJ
D. 联氨作为火箭燃料是一种清洁能源
 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值,下列叙述错误的是
①18 g金刚石中,碳碳共价键数为3NA
②1mol铜与足量硫蒸气反应,转移电子数为 NA
③常温常压时S2和S8的混合物共6.4g,其中所含硫原子数一定为0.2NA
④一定温度下,1 L 0.50 mol·L━1NH4Cl溶液与2 L 0.25mol·L━1NH4Cl溶液中NH4+的物质的量均小于0.5NA,且前者更少
⑤电解法精炼铜时,当阳极质量减少64g时,电路中通过的电子数一定为2NA
A. ② B. ②④⑤ C. ④⑤ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制乙酸乙酯得主要装置如图中A所示,主要步骤①在a试管中按2:3:2的体积比配制浓硫酸、乙醇、乙酸的混合物;②按A图连接装置,使产生的蒸气经导管通到b试管所盛的饱和碳酸钠溶液(加入几滴酚酞试液)中;③小火加热a试管中的混合液;④等b试管中收集到约2mL产物时停止加热.撤下b试管并用力振荡,然后静置待其中液体分层;⑤分离出纯净的乙酸乙酯。
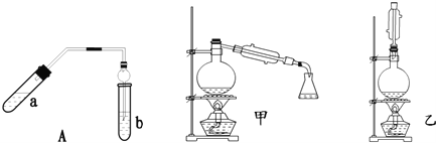
请回答下列问题:
(1)步骤①中,配制这一比例的混合液的正确操作是__;
(2)若实验中用含18O的乙醇与乙酸作用,该反应得化学方程式是:__;
(3)步骤③中,要用小火加热,其原因是__;
(4)步骤④中可观察到b试管中有细小的气泡冒出,写出该反应的离子方程式:__;
(5)A装置中使用球形管除起到冷凝作用外,另一重要作用是__,步骤⑤中分离乙酸乙酯必须使用的一种仪器是__;
(6)为充分利用反应物,甲、乙两位同学分别设计了图中甲、乙两个装置(乙同学待反应完毕冷却后,再用饱和碳酸钠溶液提取烧瓶中的产物),你认为合理的是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在理论上可设计成原电池的化学反应是( )
A. C(s)+H20(g)═CO(g)+H2(g) △H>0
B. Ba(OH)2·8H2O(s)+2NH4Cl(s)═BaCl2(aq)+2NH3+10H2O(l) △H>0
C. CaC2(s)+2H20(l)═Ca(OH)2(s)+C2H2(g) △H<0
D. CH4(g)+202(g)═CO2(g)+2H2O(l) △H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,H3AsO3和H3AsO4水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系分别如图-1和图-2所示。
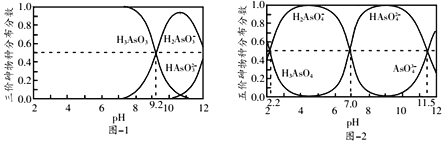
下列说法错误的是( )
A. H3AsO3和Na2HAsO4水溶液可以发生复分解反应
B. H3AsO4水溶液中存在:![]()
C. 向 H3AsO4的溶液中加入一定量的NaOH溶液至pH=5时,![]()
D. 室温下向含0.2mol H3AsO4的溶液中加入12gNaOH固体,所得溶液的pH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH4Cl溶于重水(D2O)后,溶液中存在的一水合氨和水合氢离子可能是( )
A.NH3HDO和D3O+B.NH3HDO和HD2O+C.NH3H2O和H2DO+D.以上都有可能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用沉淀滴定法快速测定NaI等碘化物溶液中c(I-),实验过程包括准备标准溶液和滴定待测溶液。
Ⅰ.准备标准溶液
a.准确称取AgNO3基准物4.246 8 g(0.0250 mol)后,配制成250 mL标准溶液,放在棕色试剂瓶中避光保存,备用。
b.配制并标定100 mL 0.100 0 mol·L-1NH4SCN标准溶液,备用。
Ⅱ.滴定的主要步骤
a.取待测NaI溶液25.00 mL于锥形瓶中。
b.加入25.00 mL 0.100 0 mol·L-1AgNO3溶液(过量),使I-完全转化为AgI沉淀。
c.加入NH4Fe(SO4)2溶液作指示剂。
d.用0.100 0 mol·L-1NH4SCN溶液滴定过量的Ag+,使其恰好完全转化为AgSCN沉淀后,停止滴定。
e.重复上述操作两次。三次测定数据如表:

f.数据处理。
回答下列问题:
(1)将称得的AgNO3配制成标准溶液,所使用的仪器除烧杯和玻璃棒外还有________。
(2)滴定应在pH<0.5的条件下进行,其原因是_____________________。
(3)b和c两步操作是否可以颠倒________,说明理由___________________________。
(4)滴定终点的现象为______________________________。测得c(I-)=________ mol·L-1。
(5)判断下列操作对c(I-)测定结果的影响(填“偏高”、“偏低”或“无影响”)
①若在配制AgNO3标准溶液时,烧杯中的溶液有少量溅出,则测定结果________。
②若在滴定终点读取滴定管刻度时,俯视标准液液面,则测定结果________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学反应的描述正确的是
A. NaHSO4溶液与Ba(OH)2溶液混合后显中性:Ba2++2OH-+2H++SO![]() ===BaSO4↓+2H2O
===BaSO4↓+2H2O
B. 向Fe2(SO4)3溶液中通入足量Na2S溶液:2Fe3++S2-===2Fe2++S↓
C. 强碱溶液中,用次氯酸钠与Fe(OH)2反应是湿法制备高铁酸钠的最主要过程,可表示为:2ClO-+Fe(OH)2===FeO42—+2Cl-+2H+
D. 将少量二氧化碳通入次氯酸钠溶液中:CO2+H2O+2ClO-===CO32—+2HClO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com