
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 2 | ⑥ | ⑦ | ||||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
分析 由元素在周期表中的位置可知,①为Na、②为K、③为Mg、④为Ca、⑤为Al、⑥为C、⑦为O、⑧为Cl、⑨为Br、⑩为Ar,
(1)同周期自左而右非金属性减弱,同主族自上而下金属性增强,金属性越强,最高价氧化物对应水化物的碱性越强;
(2)电子层数越多,半径越大,电子层数相同时,核电荷数越多,半径越小;
(3)溴化钠与氯气反应生成氯化钠与溴.
解答 解:由元素在周期表中的位置可知,①为Na、②为K、③为Mg、④为Ca、⑤为Al、⑥为C、⑦为O、⑧为Cl、⑨为Br、⑩为Ar,
(1)同周期自左而右非金属性减弱,同主族自上而下金属性增强,故金属性K>Na>Al,金属性越强,最高价氧化物对应水化物的碱性越强,则KOH的碱性最强,
故答案为:KOH;
(2)电子层数越多,半径越大,电子层数相同时,核电荷数越多,半径越小,所以②③⑧中形成的简单离子半径由大到小的顺序是Cl->K+>Mg2+,
故答案为:Cl->K+>Mg2+;
(3)溴化钠与氯气反应生成氯化钠与溴,反应的离子方程式为:Cl2+2Br-=Br2+2Cl-,
故答案为:Cl2+2Br-=Br2+2Cl-;
点评 本题考查元素周期表与元素周期律,难度不大,注意整体把握元素周期律的结构,侧重对基础知识的巩固.


科目:高中化学 来源:2016-2017学年湖北省高二上月考一化学卷(解析版) 题型:填空题
化学反应原理在科研和工农业生产中有广泛应用。
(1)某化学兴趣小组进行工业合成氨的模拟研究,反应的方程式为N2(g)+3H2(g) 2NH3(g) ΔH<0。在lL密闭容器中加入0.1 mol N2和0.3mol H2,实验①、②、③中c(N2)随时间(t)的变化如下图所示:
2NH3(g) ΔH<0。在lL密闭容器中加入0.1 mol N2和0.3mol H2,实验①、②、③中c(N2)随时间(t)的变化如下图所示:

实验②从初始到平衡的过程中,该反应的平均反应速率v(NH3)=_______________;与实验①相比,实验②和实验③所改变的实验条件分别为下列选项 中的______________、_____________(填字母编号)。
中的______________、_____________(填字母编号)。
A增大压强 B减小压强 C升高温度 D降低温度 E使用催化剂
(2)已知NO2与N2O4可以相互转化:2NO2(g) N2O4(g)。
N2O4(g)。
T℃时,将0.40 mol NO2气体充入容积为2L的密闭容器中,达到平衡后,测得容器中c(N2O4)=0.05 mol/L,则该反应的平衡常数K=_______________;
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
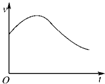 氯酸钾和亚硫酸氢钠发生氧化还原反应生成Cl(-1价)和S(+6价)的速率如图所示,已知这个反应速率随着溶液中c(H+)增大而加快.
氯酸钾和亚硫酸氢钠发生氧化还原反应生成Cl(-1价)和S(+6价)的速率如图所示,已知这个反应速率随着溶液中c(H+)增大而加快.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl3溶液和KSCN溶液混合 | B. | 锌放入稀硫酸中 | ||
| C. | 铜片放入氯化铁溶液中 | D. | 硫酸铜溶液与氢氧化钠溶液混合 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高二上月考一化学卷(解析版) 题型:选择题
一定条件下,溶液的酸碱性对TiO2光催化染料R降解反应的影响如图所示。下列判断正确的是
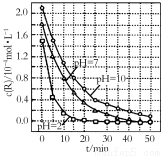
A.R的起始浓度越小,降解速率越大
B.在0~50 min之间,pH=2和pH=7时R的降解百分率相等
C.溶液酸性越 强,R的降解速率越小
强,R的降解速率越小
D.在20~25 min之间,pH=10时R的平均降解速率为0.04 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
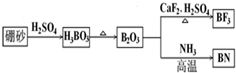
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca2+ 1s22s22p63s23p6 | B. | O2-1s22s23p4 | ||
| C. | Cl- 1s22s22p63s23p6 | D. | Ar 1s22s22p63s23p6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com