
分析 (1)酸与硝酸的混合溶液,取出10mL加入足量BaCl2溶液,过滤、洗涤、烘干后得到9.32g的沉淀为硫酸钡,根据n=$\frac{m}{M}$计算硫酸钡的物质的量,再根据硫酸根守恒n(H2SO4)=n(BaSO4),滤液中氢离子物质的量不变,与4.0mol•L-1NaOH溶液反应,用去40mL碱液时恰好完全中和,酸与氢氧化钠恰好反应,H+与OH-1:1反应,故n(HNO3)+2(H2SO4)=n(NaOH),根据c=$\frac{n}{V}$计算硫酸、硝酸的物质的量浓度;
(2)根据离子方程式:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,先判断过量问题,再利用量少的完全反应计算.
解答 解:(1)硫酸与硝酸的混合溶液,取出10mL加入足量BaCl2溶液,过滤、洗涤、烘干后得到9.32g的沉淀为硫酸钡,
硫酸根守恒故n(H2SO4)=n(BaSO4)=$\frac{9.32g}{233g/mol}$=0.04mol,故原溶液中c(H2SO4)=$\frac{0.04mol}{0.01L}$=4mol/L;
滤液中氢离子物质的量不变,与4.0mol•L-1NaOH溶液反应,用去40mL碱液时恰好完全中和,酸与氢氧化钠恰好反应,H+与OH-1:1反应,故n(HNO3)+2(H2SO4)=n(NaOH),即n(HNO3)+2×0.04mol=0.04L×4mol/L,解得n(HNO3)=0.08mol,故原溶液中c(HNO3)=$\frac{0.08mol}{0.01L}$=8mol/L,
答:混合液中H2SO4的物质的量浓度为4mol/L、HNO3的物质的量浓度是8mol/L;
(2)1.92g铜粉物质的量为0.03mol,溶液中氢离子的物质的量为10×10-3×(4×2+8×1)mol=0.16mol,根据离子方程式:
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,
3mol 8mol 44.8L
0.03mol 0.16mol V
由此可知氢离子过量,则$\frac{3mol}{0.03mol}$=$\frac{44.8L}{V}$,
解得V=0.448L,
答:收集到气体在标准状况下的体积为0.448L.
点评 本题考查化学反应方程式的计算,为高频考点,把握发生的反应、物质的量关系等为解答的关键,侧重分析与计算能力的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
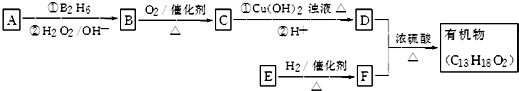
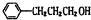 .
. ;其反应类型是取代反应.
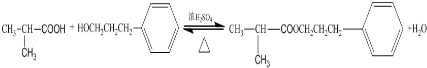
;其反应类型是取代反应.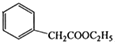 )是一种重要的医药中间体.写出以苯乙酮(
)是一种重要的医药中间体.写出以苯乙酮(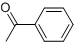 )和乙醇为主要原料制备苯乙酸乙酯的合成路线流程图(无机试剂任选).
)和乙醇为主要原料制备苯乙酸乙酯的合成路线流程图(无机试剂任选).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
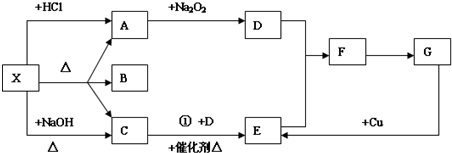
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硝酸和浓硫酸在空气中久置,酸溶液的浓度都会降低 | |
| B. | 和铜反应中都表现出强氧化性和酸性 | |
| C. | 浓硝酸常保存在棕色试剂瓶中 | |
| D. | 常温下,浓硝酸和浓硫酸不和铁、铝反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
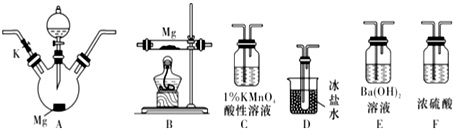
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
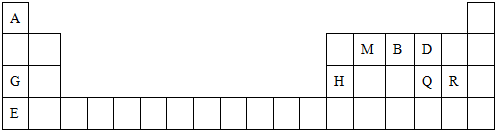
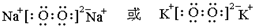 ;最高价氧化物的水化物中,酸性最强的化合物分子式为HClO4.
;最高价氧化物的水化物中,酸性最强的化合物分子式为HClO4.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4HCO3和盐酸的反应是放热反应 | |
| B. | 该反应中,热能转化为产物内部的能量 | |
| C. | 反应物的总能量高于生成物的总能量 | |
| D. | 每消耗0.1molNH4HCO3放出2.24L CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
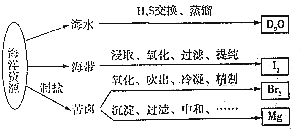
| A. | 从海水中提取D2O是化学变化 | |
| B. | 从海带中提取I2时可用乙醇进行萃取 | |
| C. | 实验室用带玻璃塞的棕色试剂瓶贮存液溴 | |
| D. | 电解饱和MgCl2溶液时在阴极得到Mg |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | a极附近溶液呈红色 | |
| B. | a极电极反应方程式是:2H++2e-=H2↑ | |
| C. | b极附近溶液呈蓝色 | |
| D. | 溶液的pH变小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com