
| A. | 除去CO2中的HCl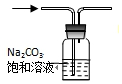 | |
| B. | 制备Fe(OH)2并能较长时间观察其颜色 | |
| C. | 验证碳酸的酸性强于硅酸 | |
| D. | 分离苯和酒精 |
分析 A.二氧化碳能够与碳酸钠溶液反应;
B.铁失去电子生成氢氧化亚铁,煤油将空气隔开,避免了氢氧化亚铁被氧化;
C.浓盐酸易挥发,干扰了检验结果;
D.苯和酒精互溶,无法通过分液分离.
解答 解:A.由于二氧化碳与碳酸钠溶液反应,则除去二氧化碳中的HCl,应该用饱和碳酸氢钠溶液,故A错误;
B.Fe为阳极,反应中铁失去电子生成亚铁离子,亚铁离子与氢氧化钠溶液反应生成氢氧化亚铁,由于煤油将空气隔开,则该装置可制备Fe(OH)2并能较长时间观察其颜色,故B正确;
C.挥发出来的HCl能够与硅酸钠溶液反应,干扰了检验,故C错误;
D.酒精能够溶于苯,混合液不分层,无法通过分液分离,故D错误;
故选B.
点评 本题考查了化学实验方案的评价,题目难度不大,涉及物质分离与提纯、酸性强弱判断等知识,明确常见化学实验基本操作方法为解答关键,试题培养了学生的化学实验能力.


科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ①④⑥ | C. | ②③⑥ | D. | ②⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钠溶液 | B. | 澄清石灰水 | C. | 2 mol/L 盐酸 | D. | 2 mol/L 硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=3的强酸溶液1 mL,加水稀释至100 mL后,溶液pH降低2个单位 | |
| B. | 1 L 0.50 mol/L NH4Cl 溶液与2 L 0.25 mol/L NH4Cl 溶液含NH4+ 物质的量后者大 | |
| C. | 误将钡盐(主要为BaCl2)当作食盐食用时,常用0.5%的Na2SO4溶液解毒;溶洞、珊瑚的形成;泡沫灭火器“泡沫”产生的原理均可用沉淀溶解平衡原理来解释 | |
| D. | pH=4、浓度均为0.1 mol•L-1 的CH3COOH、CH3COONa混合溶液中:c(CH3COO-)-c(CH3COOH)=2×(10-4-10-10)mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{1}{2}$、$\frac{1}{22.4}$ | B. | $\frac{1}{3}$、$\frac{1}{33.6}$ | C. | $\frac{2}{3}$、$\frac{1}{11.2}$ | D. | $\frac{3}{4}$、$\frac{1}{22.4}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
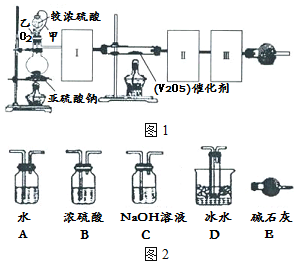
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
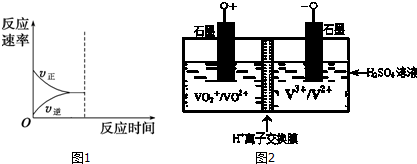
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com