
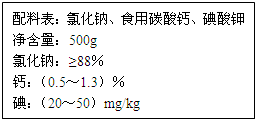
 由于饮食结构和饮食习惯的影响,缺钙是国人具有普遍性的一种现象.以食盐为载体加钙,可保证人们一日三餐持续补钙.如图是某厂生产的某种加钙食盐包装标签上的部分文字,请阅读后回答以下问题:
由于饮食结构和饮食习惯的影响,缺钙是国人具有普遍性的一种现象.以食盐为载体加钙,可保证人们一日三餐持续补钙.如图是某厂生产的某种加钙食盐包装标签上的部分文字,请阅读后回答以下问题:| 食盐中碳酸钙的质量 |
| 食盐的质量 |
| 0.1344 |
| 22.4 |
| 100g |
| X |
| 1moL |
| 0.006moL |
| 0.24g |
| 20g |
| 0.012moL |
| 0.01L |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
A、 的分子式为C17H24O3 的分子式为C17H24O3 |
| B、水溶液中氨基酸在等电点时的溶解度最小.不同的氨基酸达到等电点的pH不同,故可以通过调节溶液pH分离某些氨基酸 |
C、有机硅聚醚( )可由单体 )可由单体  和 和 缩聚而成 缩聚而成 |
| D、等质量的甲醇、甲醛、甲醚完全燃烧时的耗氧量依次递增 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、银白色的钠放置于空气中变暗 |
| B、白色的CuSO4粉末遇水变蓝 |
| C、Na2CO3溶液中加入CaCl2溶液产生白色沉淀 |
| D、活性炭使红墨水褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 b.
b. c.
c. d.
d.
| A、①④ | B、①② | C、②③ | D、①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、明矾净水和家用消毒剂的消毒原理相同 |
| B、使用含有氯化钠的融雪剂会加快桥梁的腐蚀 |
| C、铝合金的广泛使用是因为人们能用焦炭等还原剂从氧化铝中获取铝 |
| D、钒氮合金钢是“鸟巢”的主要材料之一,其熔点、硬度和强度均高于纯铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在常温常压下,2.8 gN2和CO的混合气体所含电子数为1.4NA | ||
| B、标准状况下,22.4 LCCl4含有的分子数目为NA | ||
C、1 L O.1 mol?L-1NaHCO3溶液中含有0.1NA个HCO
| ||
| D、在电解精炼粗铜的过程中,当转移电子数为 NA时,阳极溶解32 g |
查看答案和解析>>
科目:高中化学 来源: 题型:
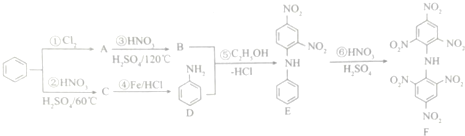
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com