
| A. | NaOH固体 | B. | Na2SO4固体 | C. | NH4Cl饱和溶液 | D. | CH3COONa固体 |
分析 一定量的稀H2SO4与过量铁粉反应时,为减缓反应速率,且不影响生成H2的总量,可以通过降低氢离子浓度来实现,但酸最终电离出氢离子物质的量不变且氢离子不能和其它物质反应生成其它气体或物质,据此分析解答.
解答 解:A.NaOH和酸反应生成水,所以影响生成氢气总量,故A错误;
B.加入硫酸钠固体,氢离子浓度不变,反应速率不变,故B错误;
C.加入饱和氯化铵溶液,氢离子浓度减小,反应速率减小,但铵根离子水解有氢离子生成,所以影响生成氢气总量,故C错误;
D.加入醋酸钠固体,醋酸钠和稀硫酸反应生成醋酸,醋酸电离程度较小,导致溶液中氢离子浓度减小,反应速率减小,但最终电离出氢离子物质的量不变,所以生成氢气总量不变,故D正确;
故选D.
点评 本题考查化学反应速率影响因素,为高频考点,注意题干中限制性条件“反应速率减缓、生成氢气总量不变”,注意D中加入醋酸钠固体和醋酸钠溶液的区别,题目难度不大.


科目:高中化学 来源: 题型:解答题
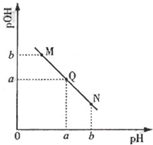 已知:25℃时,CH3COOH和NH3•H2O的电离常数相等.
已知:25℃时,CH3COOH和NH3•H2O的电离常数相等.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
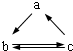 下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( ) | a | b | c |
| A | Al | AlCl3 | Al(OH)3 |
| B | HNO3 | NO | NO2 |
| C | Si | SiO2 | H2SiO3 |
| D | Na2O2 | Na2CO3 | NaHCO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “塑料王”聚四氟乙烯能使酸性高锰酸钾溶液褪色 | |
| B. | 三氯甲烷(CHCl3)可以用甲烷与氯气的取代反应来制取 | |
| C. | 四氟乙烯 (CF2=CF2)中所有的原子都在同一个平面上 | |
| D. | 四氟乙烯 (CF2=CF2)通过加聚反应生成“塑料王”聚四氟乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 生成物是HI和HClO | B. | 生成物是HCl和HIO | ||
| C. | 属于置换反应 | D. | 属于复分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 温度/℃ | 25 | 80 | 230 |
| 平衡常数 | 5×104 | 2 | 1.9×10-5 |
| A. | 上述生成Ni(CO)4(g)的反应为放热反应 | |
| B. | 25℃时反应Ni(CO)4(g)?Ni(s)+4CO(g)的平衡常数为2×10-5 | |
| C. | 在80℃时,测得某时刻,Ni(CO)4(g)、CO浓度均为0.5 mol/L,则此时v(正)>v(逆) | |
| D. | 80℃达到平衡时,测得n(CO)=0.15mol,则Ni(CO)4的平衡浓度为0.125 mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com