
| A. | 若温度不变,将容器的体积缩小到原来的一半,此时A的浓度为原来的2.1倍,则m+n<p+q | |
| B. | 若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m:n | |
| C. | 若m+n=p+q,则往含有a mol气体的平衡体系中再加入a mol的B,达到新平衡时,气体的总物质的量等于2a | |
| D. | 若温度不变时,压强增大到原来的2倍,达到新平衡时,总体积一定比原来的$\frac{1}{2}$要小 |
分析 A.若温度不变,将容器的体积缩小到原来的一半,此时A的浓度为原来的2.1倍,可知增大压强,平衡逆向移动;
B.若平衡时,A、B的转化率相等,则起始物质的量之比等于化学计量数之比;
C.若m+n=p+q,可知反应前后气体的物质的量不变;
D.m+n=p+q时,压强增大到原来的2倍,则总体积变为原来的$\frac{1}{2}$.
解答 解:A.若温度不变,将容器的体积缩小到原来的一半,此时A的浓度为原来的2.1倍,可知增大压强,平衡逆向移动,则m+n<p+q,故A正确;
B.若平衡时,A、B的转化率相等,则起始物质的量之比等于化学计量数之比,则说明反应开始时,A、B的物质的量之比为m:n,故B正确;
C.若m+n=p+q,可知反应前后气体的物质的量不变,则往含有a mol气体的平衡体系中再加入a mol的B,达到新平衡时,气体的总物质的量等于2a,故C正确;
D.m+n=p+q时,压强增大到原来的2倍,则总体积变为原来的$\frac{1}{2}$,若m+n≠p+q时,压强增大到原来的2倍,达到新平衡时,总体积比原来的$\frac{1}{2}$要小,故D错误;
故选D.
点评 本题考查化学平衡的移动,为高频考点,把握温度、浓度、压强对平衡移动的影响为解答的关键,侧重分析与应用能力的考查,注意气体的化学计量数的关系,题目难度不大.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
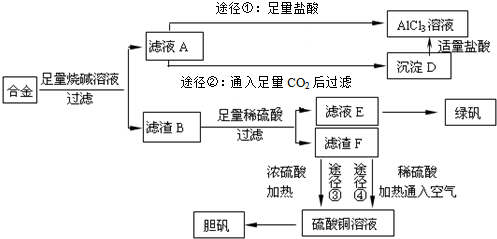
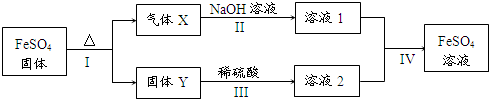
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
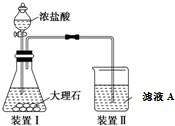
 实验室以苯甲醛为原料制备间溴苯甲醛(实验装置如图,相关物质的沸点见附表).
实验室以苯甲醛为原料制备间溴苯甲醛(实验装置如图,相关物质的沸点见附表).| 物质 | 沸点/℃ | 物质 | 沸点/℃ |
| 溴 | 58.8 | 1,2-二氯乙烷 | 83.5 |
| 苯甲醛 | 179 | 间溴苯甲醛 | 229 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据 | |
| B. | 对于能够自发进行的吸热反应,其原因是体系有自发地向混乱度增加的方向转变的倾向 | |
| C. | △H<0、△S>0的反应在温度低时不能自发进行 | |
| D. | 在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的方向 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
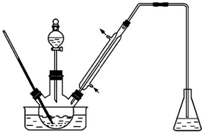
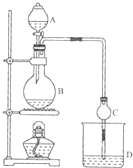 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液. 已知
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液. 已知| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com