
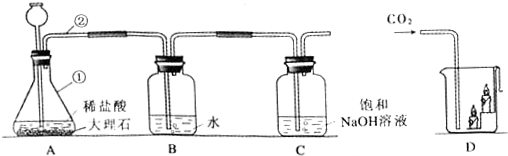
���� ��1������ͼ����������״������
��2��װ��A��ϡ���������ʯ��Ӧ�����Ȼ��ơ�������̼��ˮ��
��3����������Һ��Ļ�����÷�Һ��
��4��HCl�ӷ�����B�����������Ʒ�Ӧ��
��5��ͨ�������̼ʱ����Ϩ��˵��������̼��ȼ��Ҳ��֧��ȼ�գ�
��� �⣺��1����ͼ����������״��֪��Ϊ��ƿ����Ϊ���ܣ�
�ʴ�Ϊ�����ܣ�
��2��װ��A��ϡ���������ʯ��Ӧ�����Ȼ��ơ�������̼��ˮ���䷴Ӧ�ķ���ʽΪ��CaCO3+2HCl�TCaCl2+H2O+CO2����
�ʴ�Ϊ��CaCO3+2HCl�TCaCl2+H2O+CO2����
��3�������Һ�����ķ����ǹ��ˣ�����ͨ�����˲����ܰ�NaHCO3�������Һ�з��������
�ʴ�Ϊ�����ˣ�
��4�����ȱ��װ��B��ϡ����ӷ���HCl������NaOH��Ӧ����NaCl�����Cװ���л�����һ�����ʾ����Ȼ��ƣ�
�ʴ�Ϊ��NaCl��
��5��ͨ�������̼ʱ����Ϩ��˵��������̼��ȼ��Ҳ��֧��ȼ�գ����Թ۲쵽�²�������ϲ�������Ϩ���ɴ˲��ܵó���ʵ�������CD��
�ʴ�Ϊ��CD��
���� ���⿼����������Ʊ���������̼�����ʡ����ʵķ���ȣ���Ŀ�ѶȲ�����ʵ��ԭ���ǽ���Ĺؼ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
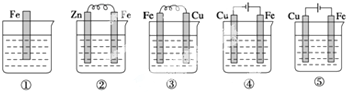
| A�� | �٢ڢۢܢ� | B�� | �ܢۢڢ٢� | C�� | �ܢۢ٢ڢ� | D�� | �ܢڢۢ٢� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 2 4 3 2 2 6 | B�� | 0 2 1 0 1 2 | ||
| C�� | 2 0 1 2 0 2 | D�� | 2 2 2 2 1 4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| �� �� | ���� | �� �� | ԭ�� |
| Na2S2O4 Ϊǿ �������Σ����� ҺΪ���ԣ� | ȡ������Һ���Թ��У��μ� ��ɫʯ����Һ | ��Һ�� ����ɫ | S2O42-ˮ�⣬ʹ��Һ�ɼ��� |
| Na2S2O4 �� S Ϊ +3 �ۣ����н�ǿ �Ļ�ԭ�ԣ� | ȡ������Һ���Թ��У��μӹ���������ˮ���� �μ� BaCl2 ��Һ | �а�ɫ������ �� | �÷�Ӧ�����ӷ���ʽ����Ϊ�� 4H2O+S2O42-+3Cl2=2SO42-+6Cl-+8H+ Ba2++SO42-=BaSO4�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
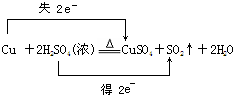 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 11.2L H2�к��е�ԭ����ΪNA�� | |
| B�� | 0.012kgC-14��Լ����6.02��1023��̼ԭ�� | |
| C�� | 18g H2O�к��е�����Ϊ3NA�� | |
| D�� | NA���������Ӻ�NA���������ӵ������ȵ���16��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ̼��������Һ�е�����������������Һ��HCO3-+OH-=CO32-+H2O | |
| B�� | ��������Һ������CO2��Ӧ��SiO32-+CO2+H2O=H2SiO3��+CO32- | |
| C�� | FeBr2��Һ��ͨ��������Cl2��2Fe2++Cl2=2Fe3++2Cl- | |
| D�� | ���Ƶ�����������������������Һ��Al2O3+2OH-=2AlO2-+H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 32g O2���32NA������ | |
| B�� | 22.4L N2���а����ӵ������������� | |
| C�� | �ڱ�״���£�22.4Lˮ������ԼΪ18g | |
| D�� | ���³�ѹ��22g��CO2���״����11.2L HCl������ͬ�ķ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | MgF2�ĵ���ʽ��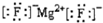 | B�� | �����ѵĽṹʽ��CH3-O-CH3 | ||
| C�� | NH3�����ģ�ͣ� | D�� | ��ԭ�ӵĽṹʾ��ͼ��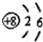 |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com