
在2 L的恒容密闭容器中充入A(g)和B(g),发生反应A(g)+B(g) 2C(g)+D(s) △H=a kJ·mol-1,实验内容和结果分别如表和图所示,下列说法正确的是
2C(g)+D(s) △H=a kJ·mol-1,实验内容和结果分别如表和图所示,下列说法正确的是

A.实验Ⅰ中,10 min内平均速率v(B)=0.06 mol·L-1·min-1
B.上述方程式中a=-160
C.600 ℃时,该反应的平衡常数是0.45
D.向实验Ⅱ的平衡体系中再充入0.5 mol A和1.5 mol B,A的转化率增大
科目:高中化学 来源:2016-2017学年辽宁省高二上开学测化学试卷(解析版) 题型:选择题
一定温度下,1molX和nmolY在体积为2L的密闭容器中发生如下反应:X(g)+Y(g) 2Z(g)+M(s),5min后达到平衡,此时生成2a mol Z。下列说法正确的是( )
2Z(g)+M(s),5min后达到平衡,此时生成2a mol Z。下列说法正确的是( )
A.用X表示此反应的反应速率是(0.1-0.2a)mol•(L•min)^-1
B.当混合气体的质量不再发生变化时,说明反应达到平衡状态
C.向平衡后的体系中加入1mol M,平衡向逆反应方向移动
D.向上述平衡体系中再充入1mol X,v(正)增大,v(逆)减小,平衡正向移动
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省高二上第二次月考化学试卷(解析版) 题型:实验题
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:

(1)已知:2Cu (s)+½O2(g) =Cu2O(s) △H=-a kJ·mol-1
C (s)+½O2(g) =CO (g) △H=-b kJ·mol-1
Cu (s)+½O2(g) =CuO (s) △H=-c kJ·mol-1
则方法I发生的反应:2CuO(s) +C(s) =Cu2O(s)+CO(g);△H__________kJ·mol-1
(2)工业上很少用方法I制取Cu2O,是由于方法I反应条件不易控制,若控温不当,会降低Cu2O产率,请分析原因:__________________。
(3)方法II为加热条件下用液态肼(N2H4)逐原新制Cu (OH)2来制备纳米级Cu2O,同时放出N2,该制法的化学方程式为____________________。
(4)方法III采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,写出电极反应式并说明该装置制备Cu2O的原理________________________。
(5)在相同的密闭容器中,用以上两种方法制得的Cu2O分别进行催化分解水的实验:
2H2O(g) 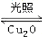 2H2(g) + O2(g) △H>O,水蒸气的浓度(mol/L)随时间t(min)变化如下表所示
2H2(g) + O2(g) △H>O,水蒸气的浓度(mol/L)随时间t(min)变化如下表所示
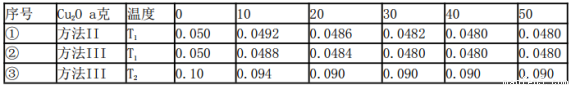
下列叙述正确的是_________(填字母代号).
a.实验的温度:T2<T1
b.实验①前20min的平均反应速率v(O2)=7×10- 5mol/(L·min)
c.实验②比实验①所用的Cu2O催化效率高
d.实验①、②、③的化学平衡常数的关系:K1=K2<K3

查看答案和解析>>
科目:高中化学 来源:2017届云南省高三第一次摸底化学试卷(解析版) 题型:选择题
已知CH3COOH与NH3·H2O的电解质强弱程度相当。室温下,向稀醋酸溶液中加入一定量的某物质后由水电离产生c(H+)=1.0×10-7mol·L-1,则加入的物质可能是
A.NaCl B.NaHSO4 C.CH3COONa D.CH3COONH4
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三上学期摸底考试化学试卷(解析版) 题型:填空题
利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,主要反应如下:
①CO(g)+2H2(g) CH3OH(g) △H=-99kJ·mol-1
CH3OH(g) △H=-99kJ·mol-1
②CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-58 kJ·mol-1
CH3OH(g)+H2O(g) △H=-58 kJ·mol-1
③CO2(g)+H2(g) CO(g)+H2O(g) △H
CO(g)+H2O(g) △H
(1)反应①的化学平衡常数K的表达式为 ;图1中能正确反映平衡常数K随温度变化关系的曲线是 ;反应③的△H= kJ·mol-1。

(2)合成气的组成n(H2)/n(CO+CO2)=2.60时体系中的CO平衡转化率α(CO)与温度和压强的关系如图2所示。图中的压强p1、p2、p3由大到小的顺序为 ;α(CO)随温度升高而减小,其原因是 。
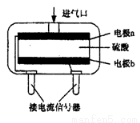
(3)为安全起见,工业生产中需对空气中的CO进行检测。
①粉红色的PdCl2溶液可以检测空气中少量的CO。若空气中含CO,则溶液中会产生黑色的Pd沉淀,每生成5.3gPd沉淀,反应中转移的电子数为 。
②使用电化学CO气体传感器定量检测空气中CO含量,其模型如图所示。这种传感器利用了原电池原理,则该电池的负极反应式为 。
(4)CO与Fe在一定条件下可形成五羰基铁[Fe(CO)5],该化合物易吸收H2生成氢化羰基铁。氢化羰基铁为二元弱酸,可与NaOH反应生成四羰基铁酸二钠。五羰基铁吸收H2的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三上学期摸底考试化学试卷(解析版) 题型:选择题
硼氢化钠(NaBH4)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,其工作原理如图所示。下列说法正确的是
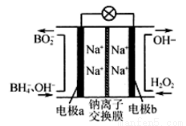
A.电极a为正极,b为负极、
C.放电时,Na+从b极区移向a极区
C.电极b上发生的电极反应为:H2O2+2e-=2OH-
D.每生成1mol BO2-转移6mol电子
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三上学期摸底考试化学试卷(解析版) 题型:选择题
下列有关物质的性质与用途具有对应关系的是
A.明矾溶于水能形成氢氧化铝胶体,可用于自来水的杀菌消毒
B.铝能置换出氧化铁中的铁,可用于钢铁工业中大量冶炼铁
C.碳酸钠具有碱性,可用于胃酸中和剂
D.氧化镁熔点高,可用于耐高温材料
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上学期摸底化学试卷(解析版) 题型:选择题
若乙醇中的氧为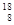 O,则它与乙酸反应生成的酯的相对分子质量为( )。
O,则它与乙酸反应生成的酯的相对分子质量为( )。
A.88 B.90 C.106 D.108
查看答案和解析>>
科目:高中化学 来源:2017届新疆生产建设兵团二中高三上第一次月考化学试卷(解析版) 题型:选择题
向一定量的Fe、FeO、Fe2O3、Fe3O4的混合物中加入150mL4mol/L的稀硝酸恰好使混合物完全溶解,放出2.24LNO(标准状况) ,往所得溶液加入KSCN溶液,无血红色出现。若用足量的H2在加热条件下还原相同质量的混合物,所得的铁的物质的量为( )
A.0.21mol B.0.25 mol C.0.3mol D.0.35mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com