
����Ŀ��25��ʱ��������Һ�е���Ũ�ȹ�ϵ��ȷ����
A. pH = 3 ��0.1 molL-1��NaHC2O4��Һ�У�c(H+ )=c(OH-)+c(C2O42-)
B. 0.1 molL-1��(NH4)2S��Һ����c(NH4+)=2c(S2-)+2c(HS-)+2c(H2S)
C. pH = 4 �� CH3COOH ��Һ�У�![]() <1
<1
D.�����ʵ���Ũ�ȡ��������NaF��Һ��HF��Һ�������ϡ��Һ����c(H+ )+ C(HF)<c(F-) + 2c(OH-)
���𰸡�D
��������A�NaHC2O4��Һ�У����ڵ���غ�������غ㣬���������غ��c��Na+��=c��HC2O4-��+c��H2C2O4��+c��C2O42-�������ݵ���غ��c��H+��+c��Na+��=c��HC2O4-��+2c��C2O42-��+c��OH-�������Ե�c��H+��+c��H2C2O4��=c��C2O42-��+c��OH-�����ʴ���B����������غ㣺c��NH3��H2O��+c(NH4+)=2c(S2-)+2c(HS-)+2c(H2S)������C�CH3COOH ��Һ�У�![]() =[c��CH3COO-����c��H+��]/[c��CH3COOH����Kw]=Ka/Kw������Ka>Kw��
=[c��CH3COO-����c��H+��]/[c��CH3COOH����Kw]=Ka/Kw������Ka>Kw��![]() >1������D���������ʵ���Ũ�ȡ��������NaF��Һ��HF��Һ�������ϡ��Һ�У����ݵ���غ㣺c��Na+��+c��H+��=c��OH-��+c��F-���������غ㣺2c��Na+��=c��HF��+c��F-����c��HF��+2c��H+��= c��F-��+2 c��OH-������c(H+ )+ C(HF)<c(F-) + 2c(OH-)����ȷ��
>1������D���������ʵ���Ũ�ȡ��������NaF��Һ��HF��Һ�������ϡ��Һ�У����ݵ���غ㣺c��Na+��+c��H+��=c��OH-��+c��F-���������غ㣺2c��Na+��=c��HF��+c��F-����c��HF��+2c��H+��= c��F-��+2 c��OH-������c(H+ )+ C(HF)<c(F-) + 2c(OH-)����ȷ��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ƽ��仯������й㷺����;��
��1�������£�Ũ�Ⱦ�Ϊ0.1mol/L����������������Һ��pH���±���
���� | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
��������Һ�е������ӣ����������������ǿ���� �����ݱ������ݣ�Ũ�Ⱦ�Ϊ0.01mol/L���������������Һ�ֱ�ϡ��100����pH�仯������ �����ţ���
A��HCN B��HClO C��CH3COOH D��H2CO3
��2���Т�100mL0.1mol/L̼������ ��100mL0.1mol/L̼����������Һ����Һ��ˮ������������Ӹ�����
�� �� ���>����=����<����ͬ������Һ�������ӵ����ʵ���Ũ��֮�ͣ��� �ڡ�
��3��̼��������һ�� ���ǿ�����������������д��HCO3-ˮ������ӷ���ʽ�� �������£�0.1mol/L̼��������Һ��pH����8������Һ��Na+��HCO3-��H2CO3��CO32-��OH-��������Ũ���ɴ�С��˳��Ϊ�� ��
��4��ʵ�����г�����������������ϴ�����ᴿ��
�ٵ�150mL1mol/L������������Һ���ձ����2.24L������̼ʱ��������Һ�и�����Ũ���ɴ�С��˳��Ϊ�� ��
�� �������ӿ�ʼ����ʱ��pH���±���
���� | Fe2+ | Cu2+ | Mg2+ |
pH | 7.6 | 5.2 | 10.4 |
������ͬŨ�ȵ�Cu2+��Mg2+��Fe2+����Һ�еμ�����������Һʱ�� (�����ӷ���)�ȳ�����Ksp[Fe(OH)3]
Ksp[Mg(OH)2] ���>����=����<������Ҫʹ0.2mol/L����ͭ��Һ��ͭ���ӳ�����Ϊ��ȫ��ʹͭ����Ũ�Ƚ���ԭ����ǧ��֮һ������Ӧ����Һ���������������Һʹ��ҺpHΪ ��
( Ksp[Cu(OH)2]=2��10-20mol2/L2)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CaCO3��ϡ���ᷴӦ�����и���ʵ���У���Ӧ��������һ����(����)
��� | �¶ȣ����� | CaCO3��״̬ | ϡ����Ũ�ȣ�mol/L�� |
A | 20 | ��״ | 1 |
B | 30 | ��״ | 1 |
C | 30 | ��״ | 2 |
D | 30 | ��״ | 2 |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������ȼ�գ�ʵ��������
A. ������ɫ���� B. ��������ɫ����
C. ���ֻ������� D. ����ҫ�۰�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶��£���һ�����0.1mol��L-1�İ�ˮ�������Ũ�ȵ����ᣬ��Һ��pOH [pOH=-lgc(OH-)]��pH�ı仯��ϵ����ͼ��ʾ������˵������ȷ��

A. M���N����Һ��H2O�ĵ���̶���ͬ
B. Q����Һ�У�c(NH4+)+c(NH3��H2O)��c(Cl-)
C. M����Һ�ĵ�����С��Q����Һ�ĵ�����
D. N����Һ��ˮϡ�ͣ�c��NH4+��/c��NH3��H2O����С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��黯�����У���ѧ��������ȫ��ͬ��ʱ�� ��
A.CaCl2�� Na2S
B.Na2O ��Na2O2
C.CO2�� CaO
D.HCl ��NaOH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������в���ȷ���ǣ� ��
A.P4��NO2���ǹ��ۻ�����
B.��SiO2�����У������ڵ���С����
C.CCl4���Լ��Լ���ϵķǼ��Է���
D.���ȼ��鲻����ͬ���칹��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͬ��ͬѹ�£������ʵ�����SO2��CO2��Ƚϣ�����������ȷ����
A��������Ϊ11:16 B���ܶȱ�Ϊ11:16
C�������Ϊ11:16 D�����Ӹ�����Ϊ1:1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���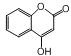 ��һ��ҽҩ�м��壬�������Ʊ�����Ѫҩ���йظ��л����˵����ȷ����
��һ��ҽҩ�м��壬�������Ʊ�����Ѫҩ���йظ��л����˵����ȷ����
A. ���л�������к���4�ֹ�����
B. lmol���л����������5mol���������ӳɷ�Ӧ
C. ���л���������������Һ������ɫ��Ӧ
D. ���л�����������������Һ��Ӧ��1mol�л����������2mol��������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com