
【题目】常用药——羟苯水杨胺,其合成路线如下。回答下列问题:
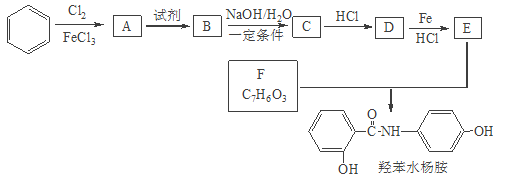
已知: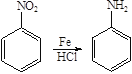
(1)羟苯水杨胺的化学式为________。对于羟苯水杨胺,下列说法正确的是_______。
A.1 mol羟苯水杨胺最多可以和2 mol NaOH反应
B.不能发生硝化反应
C.可发生水解反应
D.可与溴发生取代反应
(2)D的名称为___________。
(3)A→B所需试剂为___________;D→E反应的有机反应类型是___________。
(4)B→C反应的化学方程式为___________。
(5)F存在多种同分异构体。
①F的所有同分异构体在下列一种表征仪器中显示的信号(或数据)完全相同,该仪器是___________。
A.质谱仪 B.红外光谱仪 C.元素分析仪 D.核磁共振仪
②F的同分异构体中既能与FeCl3发生显色反应,又能发生银镜反应的物质共有______种;写出其中核磁共振氢谱显示4组峰,且峰面积之比为1:2:2:1的同分异构体的结构简式___________。(写出一种即可)
【答案】C13H11NO3C、D对硝基苯酚浓硝酸和浓硫酸还原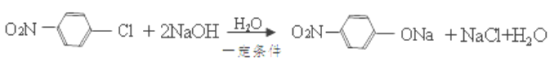 C9
C9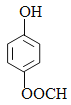 或
或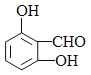 或
或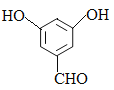
【解析】
苯和氯气在氯化铁的作用下发生取代反应生成A是氯苯,根据已知信息结合D生成E的反应条件和羟苯水杨胺的结构简式可知A生成B是氯苯的硝化反应,B的结构简式为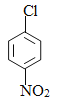 ,B发生水解反应生成C,C酸化后转化为D,则D的结构简式为
,B发生水解反应生成C,C酸化后转化为D,则D的结构简式为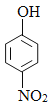 ,E的结构简式为
,E的结构简式为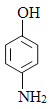 。E和F发生取代反应生成羟苯水杨胺,则F的结构简式为
。E和F发生取代反应生成羟苯水杨胺,则F的结构简式为 ,据此解答。
,据此解答。
(1)根据羟苯水杨胺的结构简式可知化学式为C13H11NO3;
A、羟苯水杨胺分子中含有2个酚羟基和1个肽键,1mol羟苯水杨胺最多和3mol氢氧化钠反应,A错误;
B、羟苯水杨胺含有苯环能发生硝化反应,B错误;
C、羟苯水杨胺含有肽键能发生水解反应,C正确;
D、羟苯水杨胺含有苯环,可与溴发生取代反应,D正确;
答案选CD;
(2)D的结构简式为 ,D是对硝基苯酚;
,D是对硝基苯酚;
(3)根据以上分析可知A→B为硝化反应,所需试剂是浓硝酸和浓硫酸;D→E是将硝基还原为氨基,反应类型是还原反应;
(4)B→C反应是氯原子在氢氧化钠溶液中水解,化学方程式为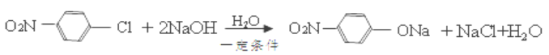 ;
;
(5)①质谱法是分析离子荷质比的方法,可以确定有机物的相对分子质量;红外光谱仪可以确定有机物中的基团;元素分析仪确定元素种类;核磁共振仪可以确定H原子种类;因此F的所有同分异构体在一种表征仪器中显示的信号(或数据)完全相同的一定是元素分析仪,答案选C;
②F是 ,能与FeCl3溶液发生显色反应说明含有酚羟基,又能发生银镜反应说明含有醛基,根据F的结构,若含有2个酚羟基、1个醛基,根据定二移一原则可知,2个羟基在邻位有2种异构体,2个羟基在间位有3种异构体,2个羟基在对位有1种异构体,若苯环有1个HCOO-和1个-OH,则有邻间对3种异构体,共9种;核磁共振氢谱显示4组峰,且峰面积之比为1:2:2:1的同分异构体的结构简式为
,能与FeCl3溶液发生显色反应说明含有酚羟基,又能发生银镜反应说明含有醛基,根据F的结构,若含有2个酚羟基、1个醛基,根据定二移一原则可知,2个羟基在邻位有2种异构体,2个羟基在间位有3种异构体,2个羟基在对位有1种异构体,若苯环有1个HCOO-和1个-OH,则有邻间对3种异构体,共9种;核磁共振氢谱显示4组峰,且峰面积之比为1:2:2:1的同分异构体的结构简式为 或
或 或
或 。
。


科目:高中化学 来源: 题型:
【题目】下列电子式书写正确的是( )
①钠离子[Na]+ ②过氧根离子![]() ③氢氧根离子
③氢氧根离子![]()
④氧原子![]() ⑤氢离子H+ ⑥铵根离子
⑤氢离子H+ ⑥铵根离子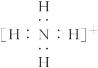
⑦铝原子Al ⑧溴离子![]()
A. ②③④⑥⑦B. ①③④⑥⑦⑧
C. ③④⑤⑥⑧D. ②③④⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有部分短周期元素的性质或原子结构如表所示:
元素编号 | 元素性质或原子结构 |
X | 其简单离子在第3周期元素的简单离子中半径最小 |
Y | 其最简单氢化物丙的水溶液呈碱性 |
Z | 原子核外电子数和周期序数相等 |
A、B、D三种单质(单质分别由X、Y、Z元素组成)和甲、乙、丙、丁、戊五种化合物之间的转化关系如图所示(某些条件已略去)。其中丁是一种火箭发动机的高能燃料,一个分子中含有18个电子,其组成元素与丙相同,戊是两性氢氧化物。
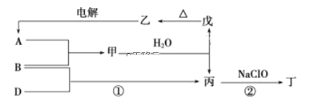
请回答:
(1)元素X在周期表中的位置是________,其简单离子的结构示意图为________。
(2)单质B电子式为________、丁电子式为________。
(3)丙中所包含的化学键类型有_______(填字母序号)。
a.离子键 b.极性共价键 c.非极性共价键
(4)反应②中,1 mol NaClO参加反应时,转移2 mol电子,其离子方程式为______________。
(5)一定条件下,A与TiO2、C(石墨)反应只生成乙和碳化钛(TiC),二者均为某些高温结构陶瓷的主要成分。该化学方程式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列转化的化学方程式,注明反应类型。
(1)甲苯→TNT ___________________
(2)苯乙烯→聚苯乙烯__________________
(3)1,3—丁二烯与溴1,4—加成__________________
(4)2-甲基-2-溴丙烷和氢氧化钾乙醇溶液共热___________________
(5)苯甲醇在铜催化下和氧气反应__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用乙醇与浓硫酸的混合液加热的方法制取乙烯。反应中常因温度而发生副反应。请选用下列装置(装置可以使用多次)完成相关实验并回答有关问题:
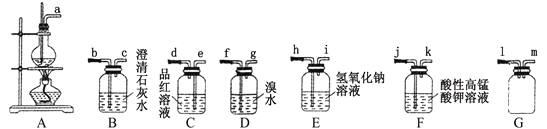
(1)制备乙烯时,常在A装置的烧瓶中加入碎瓷片,其目的是______________________;加热时要使溶液的温度迅速上升到140℃以上,因为在140℃左右易生成乙醚,该有机物的结构简式为_____________;生成乙烯的化学方程式为_____________________。
(2)乙醇与浓硫酸加热制取乙烯时,乙烯气体中常混有SO2和 CO2,为验证有副产物SO2和 CO2气体存在,上述仪器的连接顺序为a→_________________________________。
(3)某同学设计制备1,2-二溴乙烷的装置连接顺序为A→E→C→D。已知1,2-二溴乙烷的主要物理性质有:难溶于水、熔点9℃、沸点132℃、密度2.2 g·cm-3。
①E装置的作用_________________________;
②分离D装置中1,2-二溴乙烷的操作方法是加入试剂_______________ ,充分反应后进行______________操作。
③反应过程中,应将D装置放在10℃的水浴中,温度不宜过低、过高的原因是__________________________________________________。
(4)请设计验证酸性高锰酸钾溶液能将乙烯氧化为CO2的实验方案。装置连接顺序为A→_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关煤、石油、天然气等资源的说法正确的是( )
A.煤就是碳,属于单质
B.石油产品都可用于加成反应
C.天然气是一种清洁的化石燃料
D.石油裂解得到的汽油是纯净物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
Ⅰ.(1)将钠、钾、镁、铝各1mol分别投入到足量的同浓度的盐酸中,试预测实验结果:______与盐酸反应最剧烈,____与盐酸反应的速度最慢;____与盐酸反应产生的气体最多.
(2)向Na2S溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为______________________________;
(3)将NaOH溶液与NH4Cl溶液混合生成NH3·H2O,从而验证NaOH的碱性大于NH3·H2O,继而可以验证Na的金属性大于N,你认为此设计是否合理?并说明理由:_________,________________;
Ⅱ.利用图装置可验证同主族元素非金属性的变化规律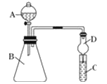
(4)干燥管D的作用为_______________;
(5)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中加Na2SiO3溶液,观察到C中溶液________________________的现象,即可证明.但有的同学认为盐酸具有挥发性,可进入C中干扰实验,应在两装置间添加装有______________溶液的洗气瓶.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镆(Mc)是115号元素,其原子核外最外层电子数是5。下列说法不正确的是
A. Mc的原子核外有115个电子 B. Mc是第七周期第VA族元素
C. Mc在同族元素中金属性最强 D. Mc的原子半径小于同族非金属元素原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列粒子的描述不正确的是( )
A. PH3的电子式为![]() ,其热稳定性不如NH3
,其热稳定性不如NH3
B. HS-的电子式为![]() ,是含有极性键的18电子的粒子
,是含有极性键的18电子的粒子
C. CH2Cl2的电子式为![]() ,是结构呈正四面体的分子
,是结构呈正四面体的分子
D. KF的电子式为![]() ,它是易溶于水的离子化合物
,它是易溶于水的离子化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com