
| A. | 以石墨作电极电解氯化铝溶液:2Cl-+2H2O═2OH-+H2↑+Cl2↑ | |
| B. | FeBr2溶液中通入足量氯气:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | |
| C. | Fe3O4与HCl:Fe3O4+8H+═2Fe3++Fe2++4H2O | |
| D. | Fe2O3与Hl:Fe2O3+6H+═2Fe3++3H2O |
分析 A.用石墨作电极电解AlCl3溶液生成氢氧化铝、氢气和氯气;
B.氯气足量,溴离子、二价铁离子都被氧化;
C.二者反应生成氯化铁、氯化亚铁;
D.三价铁离子能够氧化碘离子.
解答 解:A.用石墨作电极电解AlCl3溶液生成氢氧化铝、氢气和氯气,离子方程式:2Al3++6Cl-+6H2O$\frac{\underline{\;通电\;}}{\;}$2Al(OH)3↓+3H2↑+3Cl2↑,故A错误;
B.FeBr2溶液中通入足量氯气,离子方程式:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl-,故B错误;
C.Fe3O4与HCl,离子方程式:Fe3O4+8H+═2Fe3++Fe2++4H2O,故C正确;
D.Fe2O3溶于过量氢碘酸溶液中,反应生成亚铁离子、碘单质和水,反应的离子方程式为:Fe2O3+6H++2I-═2Fe2++I2+3H2O,故D错误;
故选:C.
点评 本题考查了离子方程式书写,明确反应实质是解题关键,注意离子反应遵循客观事实、遵循电荷守恒规律,题目难度中等.


 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:选择题
| A. | 该反应中NO2-被还原 | |
| B. | 生成1mol NaNO3需消耗0.4mol KMnO4 | |
| C. | 反应过程中溶液的pH减小 | |
| D. | □中的粒子是OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
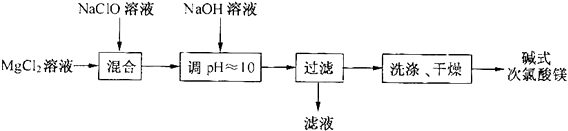
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
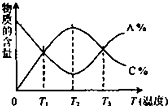 经一定时间后,可逆反应aA+bB?cC中物质的含量A%和C%随温度的变化曲线如图所示,下列说法正确的是( )
经一定时间后,可逆反应aA+bB?cC中物质的含量A%和C%随温度的变化曲线如图所示,下列说法正确的是( )| A. | 该反应在T1、T3温度时达到化学平衡 | |
| B. | 升高温度,平衡会向正反应方向移动 | |
| C. | 该反应的逆反应是放热反应 | |
| D. | 该反应在T2温度时达到化学平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
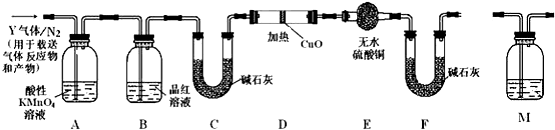
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁表面镀锌,锌作阳极 | |
| B. | 船底镶嵌锌块,锌作正极,以防船体被腐蚀 | |
| C. | 钢铁吸氧腐蚀的正极反应:O2+2H2O+4e-═4OH- | |
| D. | 工业上电解饱和食盐水的阳极反应:2Cl--2e-═Cl2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
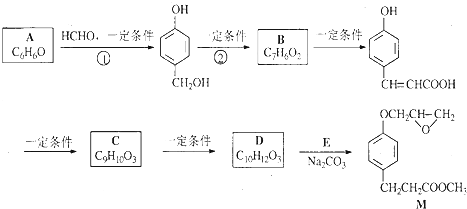
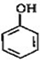 B
B C
C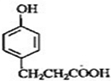
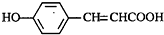 的邻位异构体分子内脱水的反应方程式
的邻位异构体分子内脱水的反应方程式 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H2O.
+H2O.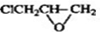 ,写出由D生成M的化学反应方程式
,写出由D生成M的化学反应方程式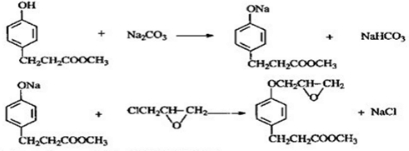 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com