
【题目】下列关于同分异构体数目的叙述不正确的是( )
A.甲苯苯环上的1个氢原子被含3个碳原子的烷基取代,所得产物有6种
B.已知丙烷的二氯代物有4种异构体,则其六氯代物的异构体数目也为4种
C.含有5个碳原子的某饱和链烃,其一氯代物有3种
D.菲的结构为 ,它与硝酸反应,可生成5种一硝基取代物
,它与硝酸反应,可生成5种一硝基取代物
科目:高中化学 来源: 题型:
【题目】环己烯是一种重要的化工原料。
(1)实验室可由环己醇制备环己烯,反应的化学方程式是______________________________________________________。
(2)实验装置如下图所示,将10 mL环己醇加入试管A中,再加入1 mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。

环己醇和环己烯的部分物理性质如下:
密度 | 熔点 | 沸点 | 溶解性 | |
环己醇 | 0.96 | 25 | 161 | 能溶于水 |
环己烯 | 0.81 | -103 | 83 | 难溶于水 |
① A中碎瓷片的作用是_____________;导管B除了导气外还具有的作用是___________________。
② 试管A置于水浴中的目的是_________________________________;
试管C置于冰水浴中的目的是_______________________________。
(3)环己烯粗品中含有少量环己醇和酸性杂质。精制环己烯的方法是:
① 向环己烯粗品中加入_________(填入编号),充分振荡后,___________________(填操作名称)。
A.Br2的CCl4溶液 B.稀H2SO4 C.Na2CO3溶液
② 再对初步除杂后的环己烯进行蒸馏,得到环己烯精品。蒸馏时,蒸馏烧瓶中要加入少量生石灰,目的是__________________________。
③ 实验制得的环己烯精品质量低于理论产量,可能的原因是_______________。
A.蒸馏时从70℃开始收集产品
B.环己醇实际用量多了
C.制备粗品时环己醇随产品一起蒸出
(4)以下区分环己烯精品和粗品的方法,合理的是________________。
A.加入水观察实验现象
B.加入金属钠观察实验现象
C.加入酸性高锰酸钾溶液,振荡后观察实验现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验中,所选取的分离装置与对应原理都正确的是 ( )

选项 | 目 的 | 装置 | 原 理 |
A | 氢氧化铁胶体的纯化 | ① | 胶体粒子不能通过滤纸,离子及小分子可以通过滤纸 |
B | 分离苯中的溴苯 | ③ | 苯(0.88 g/mL)和溴苯(1.5 g/mL)的密度不同 |
C | 粗盐提纯 | ①② | NaCl在水中的溶解度很大 |
D | 除去环己醇中的环烯 | ④ | 环己醇的沸点(161 ℃)与环己烯的沸点(83 ℃)相差较大 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生欲探究FeSO4溶液与浓HNO3的反应。
该同学向盛有FeSO4溶液的试管中滴入数滴浓硝酸,并振荡试管,预期现象为试管中会立即产生红棕色气体,溶液焰色逐渐变黄。但实际操作时观察到液面上方气体变化红棕色,且试管中溶液颜色变为深棕色。
为了进一步探究溶液变为深棕色的原因,该同学进行如下实验。
回答下列问题
(1)向FeSO4溶液和反应后溶液中加入KSCN溶液,前者不变红色,后者变红,该现象的结论是________。
(2)该同学通过查阅资料,认为溶液的深棕色可能是NO2或NO与溶液中Fe2+或Fe3+发生反应而得到的。为此他利用如图装置(气密性已检验,尾气处理装备略)进行探究。
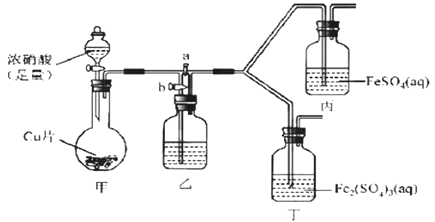
Ⅰ.打开活塞a、关闭b,并使甲装置中反应开始后,观察到丙中溶液逐渐变为深棕色,而丁中溶液无明显变化。
Ⅱ.打开活塞b、关闭a,一段时间后再停止甲中反应。
Ⅲ.为与Ⅰ中实验进行对照重新更换丙、丁后,使甲中反应重复进行步骤Ⅰ实验,观察到的现象与步骤Ⅰ中相同。
①铜与足量浓硝酸反应的离子方程式是_______________。
②装置乙的试剂为____________________。
③步骤Ⅱ的目的是_______________________。
④该实验可得出的结论是______________________。
(3)该同学重新进行FeSO4溶液与浓HNO3的反应的实验,观察到了预期现象,其实验操作是_________,反应的离子方程式为___________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】蔗糖与浓硫酸的炭化实验会产生大量的有刺激性气味的气体对环境产生污染。为此,某化学兴趣小组设计了如下装置进行实验。玻璃管中①②③分别为CO检测试纸 (浸有氯化钯洛液的滤纸,遇CO变黑色)、滴有品红溶液的滤纸、滴有酸性KMn04 溶液的滤纸,a和b分别为两个小气球。

实验步骤如下:按图示连接好仪器,然后检查装置的气密性;装好试剂,夹紧止水夹K,向A瓶中的蔗糖上小心滴加浓硫酸,片刻后可观察到A瓶内蔗糖变黑,体积膨胀,有白雾产生,气球a鼓起,玻璃管中①号滤纸白色变黑色,②号和③号滤纸均褪色。请回答以下问题:
(1)上图中盛有浓硫酸的仪器名称为________。待上述反应结束后,点燃酒精灯并在②号和③号滤纸的玻璃管近均匀加热,观察到的现象是_______。
(2)B瓶中酸性KMnO4溶液的作用是______________,发生反应的离子方程式为_____。
(3)打开止水夹K,使气球a内气体缓慢通过B瓶和C瓶,一段时间之后,发现澄清石灰水变浑浊,但此现象并不能证明该反应生成了CO2。为了证明有CO2生成并简化实验装置,可在④号位置放上滴有______的滤纸(从以下试剂中选择)。
A.品红浓液 B.酸性高锰酸钾溶液 C.溴水 D.澄清石灰水
(4)若反应生成的两种碳的氧化物在相同条件下的体积比为2:1,则滤纸炭化后体积膨胀发生反应的化学方程式可能为_________。(若是氧化还原反应,请用单线桥法在化学反应方程式上标明电子转移的方向和数目。)
(5)若在尾端没有气球b,会有什么不良结果?_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.高纯度氢氧化镁广泛应用于医药、电力等领域。镁硅酸盐矿石可用于生产氢氧化镁,简要工艺流程如图所示:

已知:
①溶液Ⅰ中除含Mg2+、SO42外,还含有少量Fe3+、Al3+、Fe2+等离子;
②常温下,几种金属离子开始沉淀和沉淀完全时的pH如下表所示:
金属离子 | Fe3+ | Al3+ | Fe2+ | Mg2+ |
开始沉淀时的pH | 1.5 | 3.3 | 6.5 | 9.4 |
沉淀完全时的pH | 3.7 | 5.2 | 9.7 | 12.4 |
请回答下列问题:
(1)镁在元素周期表中的位置_______________;
(2)向溶液Ⅱ中加入试剂X是_____________,作用是_________________________;
(3)流程中不加H2O2引起的后果是___________________________________;
(4)说出母液的一种用途___________________;
(5)加入H2O2溶液发生反应的离子方程式是___________________;
Ⅱ.海水中含有丰富的镁资源。某同学设计了从模拟海水中制备MgO的实验方案:

模拟海水中的离子浓度/ (mol/L) | Na+ | Mg2+ | Ca2+ | Cl- | HCO3- |
0.439 | 0.050 | 0.011 | 0.560 | 0.001 |
注:溶液中某种离子的浓度小于1.0×10-5 mol/L,可认为该离子不存在;实验过程中,假设溶液体积不变。
已知:Ksp(CaCO3)=4.96×10-9;Ksp(MgCO3)=6.82×10-6;Ksp [Ca(OH)2]=4.68×10-6;Ksp [Mg(OH)2]=5.61×10-12。请回答下列问题:
(6)沉淀物X为_____________;
(7)滤液N中Ca2+浓度为_______________;
(8)加NaOH固体调整pH=12.5是否可行______(填“是”“否”);原因是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com