
【题目】将露置于空气中的某氢氧化钠固体样品溶于水,向所得溶液中逐滴加入稀盐酸至过量,生成的CO2(标准状况)与加入的盐酸体积有如图关系(不考虑CO2在水中的溶解)。试计算:

(1)盐酸的物质的量浓度为__________mol/L。
(2)该样品中NaOH与Na2CO3的物质的量之比(写出计算过程,只有答案不给分)。__________
【答案】 0. 4 2︰1
【解析】试题分析:将露置于空气中的某氢氧化钠固体样品溶于水,向所得溶液中逐滴加入稀盐酸至过量,由生成的CO2的体积(标准状况)与加入的盐酸体积关系的图像可知,氢氧化钠有部分变质转化为碳酸钠;盐酸加入到混合液中后,依次发生①OH-+H+=H2O、②CO32-+H+=HCO3-、③HCO3-+H+=H2O+CO2↑,显然,反应③消耗盐酸50mL,由此可推,反应②也消耗50mL盐酸、反应①消耗100mL盐酸。反应③共生成0.448L CO2(标准状况),其物质的量为0.02mol,所以n(H+)=n(CO2)=0.02mol,则c(H+)=![]() 0.4mol/L。由离子方程式可知,反应①和反应②消耗的盐酸的体积之比等于样品中NaOH与Na2CO3的物质的量之比,即100:50=2:1.
0.4mol/L。由离子方程式可知,反应①和反应②消耗的盐酸的体积之比等于样品中NaOH与Na2CO3的物质的量之比,即100:50=2:1.
(1)盐酸的物质的量浓度为0. 4 mol/L。
(2)该样品中NaOH与Na2CO3的物质的量之比为2︰1。
计算过程如下:
(1)盐酸加入到混合液中后,依次发生①OH-+H+=H2O、②CO32-+H+=HCO3-、③HCO3-+H+=H2O+CO2↑,显然,反应③消耗盐酸50mL,由此可推,反应②也消耗50mL盐酸、反应①消耗100mL盐酸。反应③共生成0.448L CO2(标准状况),其物质的量为0.02mol,所以n(H+)=n(CO2)=0.02mol,则c(HCl)= ![]() 0.4mol/L。
0.4mol/L。
(2)由离子方程式可知,反应①和反应②消耗的盐酸的体积之比等于样品中NaOH与Na2CO3的物质的量之比,即100:50=2:1.


科目:高中化学 来源: 题型:
【题目】下列操作能促进水的电离,且使溶液呈酸性的是
A.向水中加人少量氯化铁固体B.向水中加入少量氯化铵固体
C.向水中加入少量NaHCO3固体D.向水中通入少量氯化氢气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,在某密闭容器内某一反应中M,N的物质的量随反应时间变化的曲线如图所示.下列叙述中,正确的是( ) 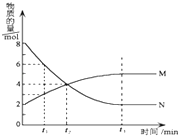
A.该反应的化学方程式为M═2N
B.若t1=1,则反应开始至t1时间段M 的反应速率为1mol﹒L﹣1﹒min﹣1
C.t2时正逆反应速率相等,反应达到平衡状态
D.t3时正反应速率等于逆反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列给定条件的溶液中,一定能大量共存的离子组是
A. ![]() = 0.1 mol/L的溶液:Na+、K+、CO32-、NO3-
= 0.1 mol/L的溶液:Na+、K+、CO32-、NO3-
B. 能使pH试纸呈红色的溶液:K+、NH4+、I-、NO3-
C. 含大量Al3+的溶液中: Na+、 HCO3-、K+、 AlO2-
D. 由水电离产生的c(H+) =10-12mol/L的溶液中:Na+、Fe2+、SO42-、ClO-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的转化在给定条件下能实现的是
①SiO2![]() Na2SiO3
Na2SiO3![]() H2SiO3
H2SiO3
②![]()
③![]()
④BaSO4![]() BaCO3
BaCO3![]() BaCl2
BaCl2
⑤![]()
A. ①③ B. ①④ C. ②④ D. ③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列反应的平衡常数:
H2(g)+S(s)H2S(g),K1;
S(s)+O2(g)SO2(g),K2 .
则反应:H2(g)+SO2(g)O2(g)+H2S(g)的平衡常数为( )
A.K1+K2
B.K﹣K2
C.K1×K2
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验操作错误的是( )
A. 用药匙取用粉末状或小颗粒状固体B. 用胶头滴管滴加少量液体
C. 给盛有2/3体积液体的试管加热D. 倾倒液体时试剂瓶标签面向手心
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com