
| 50mL 盐酸 | 50mL 盐酸 | 50mL 盐酸 | |
| m(混合物) | 9.2g | 15.7g | 27.6g |
| V(CO2) | 2.24L | 3.36L | 3.36L |
| A. | 盐酸的物质的量浓度为5.0mol•L-1 | |
| B. | 根据表中数据计算出混合物中NaHCO3的质量分数:0.457 | |
| C. | 加入固体混合物中NaHCO3和KHCO3的质量比为1:1 | |
| D. | 加入15.7g混合物时盐酸足量 |
分析 由表中数据可知,由于固体混合物从9.2 g→15.7 g,二氧化碳气体的体积还在增加,故加入9.2 g混合物时盐酸过量,而固体混合物从15.7 g→27.6 g,二氧化碳气体的体积不再变化,说明故加入27.6 g混合物时盐酸过不足,生成3.36L CO2需要固体质量为9.2g×$\frac{3.36L}{2.24L}$=13.8g<15.7g,故第2组实验中盐酸也不足.盐酸完全反应生成二氧化碳3.36L,结合H++HCO-3=H2O+CO2↑计算n(HCl),再利用c=$\frac{n}{V}$计算盐酸浓度;加入9.2g混合物时,盐酸有剩余,混合物完全反应,根据固体混合物的总质量及产生标准状况下的二氧化碳气体的体积可以计算出NaHCO3的质量分数.
解答 解:由表中数据可知,由于固体混合物从9.2 g→15.7 g,二氧化碳气体的体积还在增加,故加入9.2 g混合物时盐酸过量,而固体混合物从15.7 g→27.6 g,二氧化碳气体的体积不再变化,说明故加入27.6 g混合物时盐酸过不足,生成3.36L CO2需要固体质量为9.2g×$\frac{3.36L}{2.24L}$=13.8g<15.7g,故第2组实验中盐酸也不足,
A.盐酸完全反应生成二氧化碳3.36L,结合H++HCO-3=H2O+CO2↑,可知n(HCl)=n(CO2)=$\frac{3.36L}{22.4L/mol}$=0.15mol,故盐酸的浓度为:$\frac{0.15mol}{0.05L}$=3mol/L,故A错误;
B.第一组中盐酸不足,固体混合物完全反应,设NaHCO3和KHCO3的物质的量分别为x、y,则84x+100y=9.2g,x+y=$\frac{2.24}{22.4}$=0.1,解得:x=y=0.05mol,则碳酸氢钠的质量分数为:$\frac{84g/mol×0.05mol}{9.2g}$=0.457,故B正确;
C.根据B的计算可知,加入固体混合物中NaHCO3和KHCO3的物质的量之比为1:1,其质量之比为84:100,故C错误;
D.由上述分析可知,向50mL盐酸中加入15.7g混合物时,盐酸不足,固体混合物过量,故D错误;
故选B.
点评 本题考查混合物的有关计算,题目难度中等,根据二氧化碳的体积变化判断盐酸是否完全反应式是关键,再根据气体体积与固体质量关系进行解答.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有共价键的化合物一定是共价化合物 | |
| B. | 在共价化合物中一定含有共价键 | |
| C. | 含有离子键的化合物一定是离子化合物 | |
| D. | 全部由非金属组成的化合物可能是离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 叙述I | 叙述II |
| A | 晶体硅熔点高硬度大 | 可用于制作半导体材料 |
| B | BaSO4难溶于酸 | 用硫酸和BaCl2溶液检验SO42- |
| C | NH3极易溶于水 | NH3可用于设计喷泉实验 |
| D | NaOH可以与SiO2反应 | 用NaOH溶液雕刻工艺玻璃上的纹饰 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
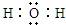 ,C和D形成的一种化合物与A2C发生氧化还原反应,该反应的离子方程式为2Na2O2+2H2O═4Na++4OH-+O2↑
,C和D形成的一种化合物与A2C发生氧化还原反应,该反应的离子方程式为2Na2O2+2H2O═4Na++4OH-+O2↑查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | H2C2O4(aq) | KMnO4(H+)(aq) | MnSO4(s) 质量(g) | 褪色时间(g) | ||
| C(mo•L-1) | V(mL) | C(mol•L-1) | V(mL) | |||
| 实验1 | 0.1 | 2 | 0.01 | 4 | 0 | 30 |
| 实验2 | 0.1 | 2 | 0.01 | 4 | 5 | 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 电离能/(kJ•mol-1) | I1 | I2 | I3 | I4 |
| A | 932 | 1 821 | 15 390 | 21 771 |
| B | 738 | 1 451 | 7 733 | 10 540 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com