
恒温下将8mol SO2和4mol O2混合,在一个密闭容器里反应,达到平衡时SO2占混合气总体积的40%。如果反应前密闭容器中的压强为3´105Pa。求:
(1)平衡时SO2的物质的量。
(2)SO2的转化率。
(3)平衡时混合气的总压强(容积恒定)。
科目:高中化学 来源: 题型:
(12分)恒温下,将a mol N2与b mol H2的混合气体通入一个5L的密闭容器中,发生如下反应:N2 (g) + 3H2(g) 2NH3(g)
(1)若反应进行到10s时,测得n (N2) = 2.8mol/L,该段时间内V(NH3) =0.08mol/(L·s),则a =__________mol;
(2)反应达平衡时,混合气体的平均相对分子质量为15.5,NH3的体积分数为25%,则平衡时NH3的物质的量为__________;
(3)原混合气体与平衡混合气体的总物质的量之比(写出最简整数比、下同),n(始)∶n(平) =__________;
(4)原混合气体中,a∶b =__________;
(5)达到平衡时,N2和H2的转化率之比,α(N2)∶α(H2)=__________;
(6)平衡混合气体中,n(N2)∶n(H2)∶n(NH3) =__________________。
查看答案和解析>>
科目:高中化学 来源:2010年安徽省高一第二学期期中考试化学试题 题型:填空题
(12分)恒温下,将a mol N2与b mol H2的混合气体通入一个5L的密闭容器中,发生如下反应:N2 (g) + 3H2(g)  2NH3(g)
2NH3(g)
(1)若反应进行到10s时,测得n (N2) = 2.8mol/L,该段时间内V(NH3) =0.08 mol/(L·s),则a =__________mol;
(2)反应达平衡时,混合气体的平均相对分子质量为15.5,NH3的体积分数为25%,则平衡时NH3的物质的量为__________;
(3)原混合气体与平衡混合气体的总物质的量之比(写出最简整数比、下同),n(始)∶n(平) =__________;
(4)原混合气体中,a∶b =__________;
(5)达到平衡时,N2和H2的转化率之比,α(N2)∶α(H2)= __________;
(6)平衡混合气体中,n(N2)∶n(H2)∶n(NH3) =__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
恒温下,将a mol N2与b mol H2的混合气体通入一个5L的密闭容器中,发生如下反应:N2 (g) + 3H2(g) ![]() 2NH3(g)
2NH3(g)
(1)若反应进行到10s时,测得n (N2) = 2.8mol/L,该段时间内V(NH3) =0.08 mol/(L·s),则a =__________mol;
(2)反应达平衡时,混合气体的平均相对分子质量为15.5,NH3的体积分数为25%,则平衡时NH3的物质的量为__________;
(3)原混合气体与平衡混合气体的总物质的量之比(写出最简整数比、下同),n(始)∶n(平) =__________;
(4)原混合气体中,a∶b =__________;
(5)达到平衡时,N2和H2的转化率之比,α(N2)∶α(H2)= __________;
(6)平衡混合气体中,n(N2)∶n(H2)∶n(NH3) =__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
(10分)二氧化硫和氮的氧化物是大气的主要污染物,防止和治理环境污染是当前环保工作的重要研究内容之一。
⑴ 一定条件下,2SO2(g)+O2(g)![]() 2SO3(g),向2 L密闭容器中通入2 mol SO2(g)、1 mol O2(g),2 min后反应达到平衡时,测得容器中含SO31.8mol,则该可逆反应的平衡常数K= ;恒温下,若往容器中再加入2 mol SO2(g)、1 mol O2(g), 重新达到平衡后, mol<SO3< mol。
2SO3(g),向2 L密闭容器中通入2 mol SO2(g)、1 mol O2(g),2 min后反应达到平衡时,测得容器中含SO31.8mol,则该可逆反应的平衡常数K= ;恒温下,若往容器中再加入2 mol SO2(g)、1 mol O2(g), 重新达到平衡后, mol<SO3< mol。
⑵ 用CH4催化还原NOx为N2可以消除氮氧化物的污染。现有1 L NO2、NO混合气体NOx,将其还原成N2,需同温同压下CH4的体积0.4 L,则混合气体中NO2、NO的物质量之比为 。
⑶ 新型纳米材料氧缺位铁酸盐(ZnFe2Ox),由铁酸盐(ZnFe2O4)经高温还原制得,常温下,它能使工业废气中的酸性氧化物分解除去,转化流程如图所示:
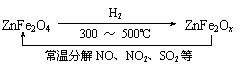
若2 mol ZnFe2Ox与SO2可生成0.75 mol S,x= 。求可分解⑵中混合气体体积V(标准状况下)。(写出计算过程)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com