
某化学兴趣小组在实验室对某固体催化剂(可能含有FeO、Fe2O3中的一种或两种)中铁元素的价态进行探究(已知:Fe2+能使高锰酸钾的酸性溶液褪色,反应式为:5 Fe2++MnO4—+8H+==5Fe3++Mn2++4H2O)。
(1)将该固体催化剂在稀硫酸中溶解,请写出这两种氧化物与稀硫酸反应的离子方程式:
、 。
(2)请完成对铁元素价态的探究:
限选实验仪器与试剂:烧杯、试管、玻璃棒、药匙、滴管、酒精灯、试管夹;
3 mol·L-1H2SO4,3% H2O2、6 mol·L-1HNO3、饱和氯水、0.01 mol·L-1KmnO4、0.1 mol·L-1KI、20% KSCN溶液、蒸馏水。
①提出合理假设
假设1: ;
假设2: ;
假设3:催化剂中铁元素的价态既有+3价又有+2价。
①设计实验方案证明你的假设(不要在答题卡上作答)
②实验过程
根据②的实验方案,进行实验。请在答题卡上按下表格式写出实验操作步骤、预期现象与结论。
| 实验操作 | 预期现象与结论 |
| 步骤1:将适量稀H2SO4加入少许样品于试管中,加热溶解;然后将所得溶液分置 于A、B试管中。 | 溶液呈黄绿色,说明溶液中含Fe2+或Fe3+。 |
| 步骤2: | |
| 步骤3: | |
| … |
解析:(1) FeO+2H+==Fe2++H2O(1分) ;Fe2O3+6H+==2Fe3++3H2O(方程式先且顺序不限1分)
(2) ①提出合理假设 假设1:催化剂中铁元素的价态只有+3价(1分)。
假设2:催化剂中铁元素的价态只有+2价(1分)。(假设1和假设2先后顺序不限,但表格中的答案必须与假设对应)
假设3:
②设计实验方法证明你的假设
③实验过程
| 实验操作 | 预期现象与结论 |
| 步骤2:在A试管中滴加几滴0.01 mol·L-1KmnO4溶液。(1分) | 若紫红色褪去,证明有Fe2+,假设2或假设3成立。(1分) |
| 步骤3:在B试管中滴加几滴KSCN溶液。 (1分) | 若溶液变为血红色,说明有Fe3+,假设1或假设3成立(即既含有二价铁,又含有三价铁);若步骤2、步骤3均有现象,则假设3成立。 (1分) |
表格中的其它描述只要合理,均可参照本答案给分。


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:阅读理解

| 序号 | 反应 | 平衡常数 |
| ① | Au+6HNO3(浓)?Au(NO3)3+3NO2+3H2O | <<1 |
| ② | Au3++4Cl-?AuCl4- | >>1 |

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| n(ClO-) | n(ClO3-) |

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| 序号 | 反应 | 平衡常数 |
| 1 | Au+6HNO3(浓)═Au(NO3)3+3NO2↑+3H2O | <<1 |
| 2 | Au3++4Cl-═AuCl4- | >>1 |

查看答案和解析>>
科目:高中化学 来源: 题型:
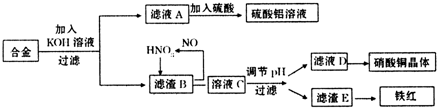


查看答案和解析>>
科目:高中化学 来源: 题型:
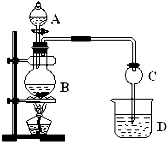 某化学兴趣小组设计实验制取乙酸乙酯.现用如图装置进行实验,在圆底烧瓶内加入碎瓷片,再加入由2mL 98%的浓H2SO4和3mL乙醇组成的混合液,通过分液漏斗向烧瓶内加入2mL冰醋酸,烧杯中加入饱和Na2CO3溶液.请回答下列问题:
某化学兴趣小组设计实验制取乙酸乙酯.现用如图装置进行实验,在圆底烧瓶内加入碎瓷片,再加入由2mL 98%的浓H2SO4和3mL乙醇组成的混合液,通过分液漏斗向烧瓶内加入2mL冰醋酸,烧杯中加入饱和Na2CO3溶液.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com