
(8分)为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的反应热,并采取相应措施。化学反应的反应热通常用实验进行测定,也可进行理论推算。
(1)实验测得,5g甲醇(CH3OH)液体在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,则表示甲醇标准燃烧热的热化学方程式为: 。
(2)今有如下两个热化学方程式:?则a b(填“>”、“=”或“<”)
H2(g)+ 1/2O2(g)=H2O(g) ΔH1=a kJ·mol-1?
H2(g)+ 1/2O2(g)=H2O(l) ΔH2=b kJ·mol-1?
(3)拆开1mol气态物质中某种共价键需要吸收的能量叫键能。从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量。
化学键 | H-H | N-H | N≡N |
键能/kJ·mol-1 | 436 | 391 | 945 |
已知反应N2(g)+3H2(g)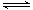 2NH3(g) △H=a kJ·mol-1。试根据表中所列键能数据估算a的值:_______________(注明“+”或“-”)。
2NH3(g) △H=a kJ·mol-1。试根据表中所列键能数据估算a的值:_______________(注明“+”或“-”)。
(4)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的反应热进行推算。利用水煤气合成二甲醚的三步反应如下:
① 2H2(g) + CO(g)  CH3OH(g);ΔH =-90.8 kJ·mol-1
CH3OH(g);ΔH =-90.8 kJ·mol-1
② 2CH3OH(g)  CH3OCH3(g) + H2O(g);ΔH=-23.5 kJ·mol-1
CH3OCH3(g) + H2O(g);ΔH=-23.5 kJ·mol-1
③ CO(g) + H2O(g)  CO2(g) + H2(g);ΔH=-41.3 kJ·mol-1
CO2(g) + H2(g);ΔH=-41.3 kJ·mol-1
总反应:3H2(g) + 3CO(g)  CH3OCH3(g) + CO2 (g)的ΔH= ;
CH3OCH3(g) + CO2 (g)的ΔH= ;
(1)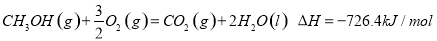 ;(2)>;(3)-93;(4)-246.4 kJ·mol-1
;(2)>;(3)-93;(4)-246.4 kJ·mol-1
【解析】
试题分析:燃烧热是指1mol燃料完全燃烧生成稳定氧化物放出的热量,1mol甲醇燃烧放出的能量为726.4Kj;表示甲醇标准燃烧热的热化学方程式为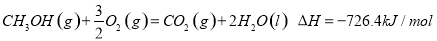 ;(2)已知:H2O(l) =H2O(g) ΔH>0;根据盖斯定律,H2O(l) =H2O(g) ΔH=(a-b) kJ·mol-1,所以a-b>0,a>b;(3)N2(g)+3H2(g)
;(2)已知:H2O(l) =H2O(g) ΔH>0;根据盖斯定律,H2O(l) =H2O(g) ΔH=(a-b) kJ·mol-1,所以a-b>0,a>b;(3)N2(g)+3H2(g)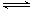 2NH3(g) △H=a kJ·mol-1,945+3×436-6×391=a;所以a=-93 kJ·mol-1;(4)根据盖斯定律①×2+②+③得3H2(g) + 3CO(g)
2NH3(g) △H=a kJ·mol-1,945+3×436-6×391=a;所以a=-93 kJ·mol-1;(4)根据盖斯定律①×2+②+③得3H2(g) + 3CO(g)  CH3OCH3(g) + CO2 (g)的ΔH=-246.4 kJ·mol-1。
CH3OCH3(g) + CO2 (g)的ΔH=-246.4 kJ·mol-1。
考点:本题考查反应热、盖斯定律。


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源:2014秋福建省高二上学期期中化学(文)试卷(解析版) 题型:填空题
(10分)化学兴趣小组为探究某铁矿石(主要成分为Fe2O3和SiO2)的性质,进行如下实验:

(1)步骤(I)中分离溶液和沉淀的操作名称是 ;
(2)沉淀A中一定含有 ,该物质属于 (填“酸性”或“碱性”)氧化物;
(3)往滤液Y中加入KSCN溶液,溶液呈 (填“黄色”或“红色”)
(4)写出步骤(Ⅱ)中生成Fe(OH)3的离子方程式 。
查看答案和解析>>
科目:高中化学 来源:2014秋湖北省武汉市高二上学期期中联考化学试卷(解析版) 题型:选择题
一定量的稀硫酸与过量的锌反应,为减慢反应速率,且不影响生成氢气的总量,可向稀硫酸中加入适量的下列物质,其中一定不能达到目的的是
A.硫酸铜固体 B.水 C.醋酸钾溶液 D.氯化钠溶液
查看答案和解析>>
科目:高中化学 来源:2014秋湖北省武汉市高一上学期期中联考化学试卷(解析版) 题型:选择题
在xR2+ +yH+ +O2=mR3+ +nH2O的离子方程式中,对m和R3+判断正确的是
A.m=4,R3+是氧化产物
B.m=2y,R3+是氧化产物
C.m=2,R3+是还原产物
D.m=y,R3+是还原产物
查看答案和解析>>
科目:高中化学 来源:2014秋浙江省杭州地区六校高二上学期期中考试化学试卷(解析版) 题型:计算题
(6分)在一定温度下,将2molA和2molB两种气体混合放入体积为2L的密闭刚性容器中,发生如下反应:3A(g)+B(g)  xC(g)+2D(g) △H<0,2min末反应达到平衡,生成0.8molD,并测得C的浓度为0.4mol?L-1。请回答:
xC(g)+2D(g) △H<0,2min末反应达到平衡,生成0.8molD,并测得C的浓度为0.4mol?L-1。请回答:
(1)x的值为_______
(2)A的转化率为α(A)%=______ ________
(3)此温度下该反应的平衡常数K=
查看答案和解析>>
科目:高中化学 来源:2014秋浙江省杭州地区六校高二上学期期中考试化学试卷(解析版) 题型:选择题
在一定温度下的刚性密闭容器中,当下列哪些物理量不再发生变化时,表明下述反应:
A(s)+2B(g)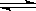 C (g)+D(g) 已达到平衡状态的是
C (g)+D(g) 已达到平衡状态的是
混合气体的压强,②C的物质的量浓度,③A的物质的量,
④2υ正( B) =υ逆(C ),⑤混合气体的平均相对分子质量
A.②④⑤ B.②③④ C.①②③ D.②③⑤
查看答案和解析>>
科目:高中化学 来源:2014秋浙江省杭州地区六校高二上学期期中考试化学试卷(解析版) 题型:选择题
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O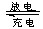 3Zn(OH)2+2Fe(OH)3+4KOH。下列叙述不正确的是:
3Zn(OH)2+2Fe(OH)3+4KOH。下列叙述不正确的是:
A.放电时负极反应为: Zn-2e―+2OH―=Zn(OH)2
B.充电时阳极反应为:Fe(OH)3-3e―+5OH―=FeO42-+4H2O
C.放电时每转移3mol电子,正极有1molK2FeO4被氧化
D.放电时的正极在充电时须接电源正极
查看答案和解析>>
科目:高中化学 来源:2014秋浙江省杭州地区六校高一上学期期中考试化学试卷(解析版) 题型:选择题
已知反应:①Cl2+2KBr=2KCl+Br2, ②KClO3 +6HCl(浓)=3Cl2+KCl +3H2O,
③Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,下列说法正确的是:
A.反应①中的氧化剂Cl2,氧化产物是KCl
B.氧化性由强到弱顺序为 Cl2>KClO3>Br2
C.反应③中的HNO3体现了酸性和氧化性
D.反应③中有0.4mol HNO3参加反应时,转移电子物质的量为0.4mol
查看答案和解析>>
科目:高中化学 来源:2014秋河北省、临漳一中、永年二中高二上学期期中联考化学试卷(解析版) 题型:选择题
设C+CO2?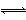 ?2CO ΔH>0的反应速率为v1,N2 +3H2
?2CO ΔH>0的反应速率为v1,N2 +3H2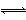 ??2NH3 ΔH<0的反应速率为v2,对于上述反应,当温度升高时,v1和v2的变化情况为
??2NH3 ΔH<0的反应速率为v2,对于上述反应,当温度升高时,v1和v2的变化情况为
A.同时增大 B.同时减小
C.v1增大,v2减小 D.v1减小,v2增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com