
分析 (1)1mol N2(g)与适量H2(g)起反应,生成2mol NH3(g),放出92.2kJ热量,标注物质聚集状态和对应反应的焓变得到热化学方程式;
(2)热化学方程式的书写,需要注意的有:物质的状态、反应热的数值与单位,反应热的数值与化学方程式前面的系数成正比;
(3)先判断温度差的有效性,然后求出温度差平均值.
解答 解:(1)1mol N2与适量H2起反应生成NH3,放出92.2kJ热量,则热化学方程式为N2(g)+3H2(g)=2NH3(g)△H=-92.2kJ•mol-1,
故答案为:N2(g)+3H2(g)=2NH3(g)△H=-92.2kJ•mol-1;
(2)1mol N2 (g)与适量O2(g)起反应,生成NO(g),吸收68kJ热量,反应吸热时焓变值为正值,所以该反应的热化学方程式为N2(g)+2O2(g)=2NO(g)△H=+68kJ•mol-1,
故答案为:N2(g)+2O2(g)=2NO(g)△H=+68kJ•mol-1;
(3)三次温度差分别为①2.2℃②2.4℃③3.4℃,第③组数据舍去,温度差平均值=$\frac{2.2°C+2.4°C}{2}$=2.3℃,故答案为:2.3℃.
点评 本题考查了热化学方程式的书写、误差分析和数据处理,题目难度不大,注意掌握热化学方程式的书写规则.


科目:高中化学 来源: 题型:选择题
| A. | 反应速率用于衡量化学反应进行的快慢 | |
| B. | 决定反应速率的主要因素是反应物的性质 | |
| C. | 反应速率越大,反应现象就一定越明显 | |
| D. | 增大反应物的浓度、提高反应温度都能增大反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醇的官能团是羟基(-OH) | B. | 酚的官能团是羟基(-OH) | ||
| C. | 醛的官能团是醛基(-CHO) | D. | 羧酸的官能团是羟基(-OH) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
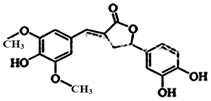 图示为一种天然产物,具有一定的除草功效,下列有关该化合物的说法正确的是( )
图示为一种天然产物,具有一定的除草功效,下列有关该化合物的说法正确的是( )| A. | 分子中含有三种官能团 | |
| B. | 1 mol 该化合物最多能与6 mol NaOH 反应 | |
| C. | 既可以发生取代反应,又能够发生加成反应 | |
| D. | 既能与FeCl3发生显色反应,也能和NaHCO3反应放出CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
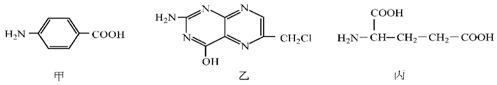
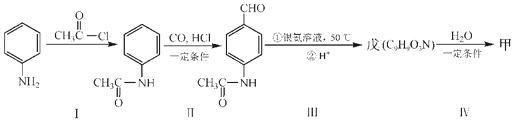
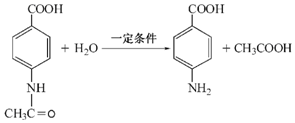 .
.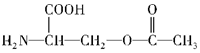 .
.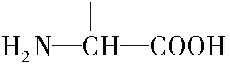 b.在稀硫酸中水解有乙酸生成.
b.在稀硫酸中水解有乙酸生成.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
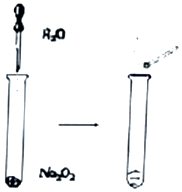 Na2O2具有强氧化性,可以用来漂白纺织累物品、麦秆、纤维等.
Na2O2具有强氧化性,可以用来漂白纺织累物品、麦秆、纤维等.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com