
. 下列物质的分离方法不正确的是
A. 用过滤的方法除去食盐中泥沙 B. 用蒸馏的方法将自来水制成蒸馏水
C. 用酒精萃取碘水中的碘 D. 用水冲洗的方法从沙里淘金
科目:高中化学 来源: 题型:
| 物 质 | 杂 质 | 所 选 试 剂 | 方 法 | |
| A | 乙烷 | 乙烯 | 酸性KMnO4溶液 | 洗气 |
| B | 溴苯 | 溴 | H2O | 萃取 |
| C | 乙酸 | 苯酚 | NaOH溶液 | 蒸馏 |
| D | 乙酸乙酯 | 乙酸 | 饱和Na2CO3溶液 | 分液 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源:2010年黑龙江省四校联考一模(理综)化学部分 题型:填空题
[化学——选修化学与技术](15分)
工业上合成氨是在一定条件下进行如下反应:N2(g)+3H2(g) 2NH3(g),其
2NH3(g),其
部分工业流程如下:
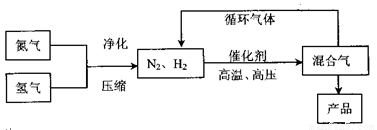
回答下列问题:
(1)已知:N2(g)+O2(g)=2NO(g) △H=180.5kJ/mol
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H=-905kJ/mol
2H2(g)+O2(g)=2H2(g) △H=-483.6kJ/mol
则N2(g)+2H2 2NH3(g)的△H=
;
2NH3(g)的△H=
;
(2)如果工业上,在一定温度下,将1.5molN2气体和6molH2气体通入到体积为1升的密闭容器中。当反应达到平衡时,容器内气体的压强为起始时的80%,则其平衡常数为 。改变下列条件,能使平衡向正反应方向进行且平衡常数不变的是 ;
①增大压强 ②增大反应物质的浓度
③使用催化剂 ④降低温度
(3)合成氨反应的平衡常数很小,所以在工业采取气体循环的流程。即反应后通过降低混合气体的温度而使氢气分离出来。这种分离物质的方法其原理类似于下列哪种方
法? (填编号)
①过滤 ②蒸馏 ③渗析 ④萃取
理由是 ;
(4)可以用氯气来检验输送氨气的管道是否漏气,如果漏气则会有白烟(成份为氯化铵)生成。该反应的化学方程式为 ;
(5)假如该厂生产氨水的物质的量浓度为20mol/L,实验室若需用80mL浓度为5mol/L的氨水时,需取20mol/L的氨水 mL(用100mL的容量瓶)。假如该氨水的pH=a,加入相同体积的盐酸时,溶液呈中性,则此盐酸的pH 14-a(填“大于”“小于”或“等于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
[化学——选修化学与技术]
工业上合成氨是在一定条件下进行如下反应:N2(g)+3H2(g)![]() 2NH3(g),其
2NH3(g),其
部分工业流程如下:

回答下列问题:
(1)已知:N2(g)+O2(g)=2NO(g) △H=180.5kJ/mol
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H=-905kJ/mol
2H2(g)+O2(g)=2H2(g) △H=-483.6kJ/mol
则N2(g)+2H2![]() 2NH3(g)的△H= ;
2NH3(g)的△H= ;
(2)如果工业上,在一定温度下,将1.5molN2气体和6molH2气体通入到体积为1升的密闭容器中。当反应达到平衡时,容器内气体的压强为起始时的80%,则其平衡常数为 。改变下列条件,能使平衡向正反应方向进行且平衡常数不变的是 ;
①增大压强 ②增大反应物质的浓度
③使用催化剂 ④降低温度
(3)合成氨反应的平衡常数很小,所以在工业采取气体循环的流程。即反应后通过降低混合气体的温度而使氢气分离出来。这种分离物质的方法其原理类似于下列哪种方
法? (填编号)
①过滤 ②蒸馏 ③渗析 ④萃取
理由是 ;
(4)可以用氯气来检验输送氨气的管道是否漏气,如果漏气则会有白烟(成份为氯化铵)生成。该反应的化学方程式为 ;
(5)假如该厂生产氨水的物质的量浓度为20mol/L,实验室若需用80mL浓度为5mol/L的氨水时,需取20mol/L的氨水 mL(用100mL的容量瓶)。假如该氨水的pH=a,加入相同体积的盐酸时,溶液呈中性,则此盐酸的pH 14-a(填“大于”“小于”或“等于”)。
查看答案和解析>>
科目:高中化学 来源:2013届浙江省杭州地区七校高二下学期期中联考化学试卷(解析版) 题型:填空题
(12分)能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上合成甲醇的反应为:CO(g)+2H2(g) CH3OH(g);ΔH
CH3OH(g);ΔH
(1)已知,该反应在300℃,5MPa条件下能自发进行,则ΔH 0,△S 0 (填“<,>或=”)。
(2)在300℃,5MPa条件下,将0.20mol的 CO与0.58mol H2的混合气体充入2L密闭容器发生反应,反应过程中甲醇的物质的量浓度随时间的变化如图所示。

①在0~2min内,以H2表示的平均反应速率为 mol·L-1·s-1 。
②列式计算300℃时该反应的平衡常数K = 。
③300℃时,将0.50mol CO、1.00mol H2和1.00 mol CH3OH充入容积为2L的密闭容器中,此时反应将 。
A.向正方向移动 B.向逆方向移动 C.处于平衡状态 D.无法判断
④下列措施可增加甲醇产率的是
A.压缩容器体积 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.再充入0.20mol CO和0.58mol H2
(3)若其它条件不变,使反应在500℃下进行,在图中作出甲醇的物质的量浓度随时间的变化的示意图。
【解析】(1)根据反应的特点可知△S小于0,因为反应在300℃,5MPa条件下能自发进行,所以根据△G=△H-T·△S可知反应是放热反应。
(2)①反应速率通常用单位时间内浓度的变化量来表示,根据图像可知反应进行到2min时甲醇
的浓度不再发生变化,平衡时甲醇的物质的量是0.04mol,则消耗氢气是0.08mol,所以在0~2min
内,以H2表示的平均反应速率为 。
。
②平衡时氢气的浓度是 ,CO的平衡浓度是
,CO的平衡浓度是
 ,所以该温度下的平衡常数为
,所以该温度下的平衡常数为 。
。
③300℃时,将0.50mol CO、1.00mol H2和1.00 mol
CH3OH充入容积为2L的密闭容器中,此时它们的浓度分别为0.25mol/L、0.50mol/L、、0.50mol/L,因为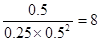 >4,所以反应向逆反应方向移动。
>4,所以反应向逆反应方向移动。
④压缩体积,压强增大,平衡向正反应方向移动。选项B是降低生成物浓度,平衡也向正反应方
向移动。充入He,使体系总压强增大,但物质但浓度没有变化,所以平衡不移动。再充入0.20mol
CO和0.58mol H2,相当于增大体系的压强,平衡向正反应方向移动,所以答案是ABD。
(3)因为反应是放热反应,所以升高温度平衡向逆反应方向移动,但反应速率会加快,所以图
像为

查看答案和解析>>
科目:高中化学 来源:模拟题 题型:单选题
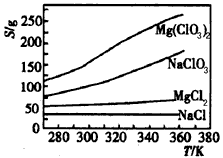
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com