
氧化锌粉末广泛应用于橡胶、涂料、陶瓷、化工、医药、玻璃等行业,为综合应用资源,常从冶炼锌、锌制品加工企业回收的锌渣(含有ZnO、FeO、Fe2O3、CuO、Al2O3等杂质)来制取氧化锌,流程如图:

有关氢氧化物沉淀完全的pH见下表:

(1)在酸浸过程中,常将锌渣碎成粉末并通入空气,同时保持酸过量,理由是 。
(2)上述工艺多处涉及“过滤”,实验室中过滤需要使用的玻璃仪器有烧杯、 。
(3)①在“除杂Ⅰ”中,常用酸性KMnO4溶液,其目的是 ,KMnO4是该反应的 (氧化剂、还原剂)。将溶液的pH调至4,目的是 。
②在“除杂II”中,加入锌粉的目的是 。
(4)在“碳化合成”中,产物中有碱式碳酸锌[Zn2(OH)2CO3]和CO2等,请写出该反应的化学方程式 。
(5)本工艺中,过滤分离次数较多,其明显的缺陷是 。
(1)增大反应面积,加快反应速率(2分);保证锌渣充分反应。(1分)
(2)玻璃棒、漏斗 (2分,漏写一个得1分)
(3)①将Fe2+ 转化成为Fe3+ (2分),氧化剂(1分) 使Fe3+ 完全转化为Fe(OH)3沉淀(2分)
②除去溶液中的Cu2+(或调节溶液的pH值)(2分)
(4)2Na2CO3+2Zn(NO3)2+H2O=4NaNO3+Zn2(OH)2CO3+CO2↑(2分,未配平扣1分)
(5)过滤次数较多,锌元素损失较多(2分)
【解析】
试题分析:(1)酸浸采取的措施与加快反应速率、提高浸出率或原料的利用率;
(2)过滤需要漏斗、玻璃棒、烧杯等玻璃仪器;
(3)酸性高锰酸钾溶液具有强氧化性,将Fe2+ 转化成为Fe3+,调节pH使Fe3+ 完全转化为Fe(OH)3沉淀;锌比铜活泼,可以除去溶液中的Cu2+(或调节溶液的pH值);
(4)由原子守恒可知,2Na2CO3+2Zn(NO3)2+H2O=4NaNO3+Zn2(OH)2CO3+CO2↑;
(5)过滤次数较多,锌元素损失较多,降低产率。
考点:本题考查化学工艺流程题。


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:阅读理解

| ||
| ||
W1-
| ||
| W1 |
W1-
| ||
| W1 |
W1-
| ||
| W1 |
W1-
| ||
| W1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(12分)氧化锌为白色粉末,无臭、无味,广泛应用于橡胶、涂料、陶瓷、化工、医药、玻璃和电子等行业,为了变废为宝,综合应用资源,经常从锌冶炼、锌制品加工企业回收的废渣(含有ZnO、FeO、Fe2O3、CuO、Al2O3等杂质)来制取氧化锌,其流程如下图所示:
有关氢氧化物沉淀完全的pH见下表
回答下列问题
(1)在酸浸过程中,经常要保持酸过量,而且要通入空气,理由是 。
(2)上述工艺流程中多处涉及“过滤”,实验室中过滤操作需要使用的玻璃仪器有 。
(3)在“除杂Ⅰ”步骤中,经常使用酸性高锰酸钾溶液,并调节溶液的pH。将溶液调至pH=4的目的是 。
(4)在“碳化合成”中,生成的产物之一为碱式碳酸锌[Zn2(OH)2CO3],请写出碳化合成步骤的化学方程式 。
(5)在“洗涤”过程中,证明沉淀洗涤完全的标志是 。
(6)由于本工艺液固分离次数较多,明显的不足是 。
查看答案和解析>>
科目:高中化学 来源:2012届江苏省淮阴中学、海门中学、天一中学高三上学期联考化学试卷 题型:填空题
(12分)氧化锌为白色粉末,无臭、无味,广泛应用于橡胶、涂料、陶瓷、化工、医药、玻璃和电子等行业,为了变废为宝,综合应用资源,经常从锌冶炼、锌制品加工企业回收的废渣(含有ZnO、FeO、Fe2O3、CuO、Al2O3等杂质)来制取氧化锌,其流程如下图所示:
有关氢氧化物沉淀完全的pH见下表
回答下列问题
(1)在酸浸过程中,经常要保持酸过量,而且要通入空气,理由是 。
(2)上述工艺流程中多处涉及“过滤”,实验室中过滤操作需要使用的玻璃仪器有 。
(3)在“除杂Ⅰ”步骤中,经常使用酸性高锰酸钾溶液,并调节溶液的pH。将溶液调至pH=4的目的是 。
(4)在“碳化合成”中,生成的产物之一为碱式碳酸锌[Zn2(OH)2CO3],请写出碳化合成步骤的化学方程式 。
(5)在“洗涤”过程中,证明沉淀洗涤完全的标志是 。
(6)由于本工艺液固分离次数较多,明显的不足是 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年江苏省、海门中学、天一中学高三上学期联考化学试卷 题型:填空题
(12分)氧化锌为白色粉末,无臭、无味,广泛应用于橡胶、涂料、陶瓷、化工、医药、玻璃和电子等行业,为了变废为宝,综合应用资源,经常从锌冶炼、锌制品加工企业回收的废渣(含有ZnO、FeO、Fe2O3、CuO、Al2O3等杂质)来制取氧化锌,其流程如下图所示:
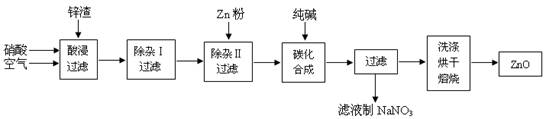
有关氢氧化物沉淀完全的pH见下表
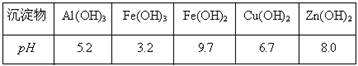
回答下列问题
(1)在酸浸过程中,经常要保持酸过量,而且要通入空气,理由是 。
(2)上述工艺流程中多处涉及“过滤”,实验室中过滤操作需要使用的玻璃仪器有 。
(3)在“除杂Ⅰ”步骤中,经常使用酸性高锰酸钾溶液,并调节溶液的pH。将溶液调至pH=4的目的是 。
(4)在“碳化合成”中,生成的产物之一为碱式碳酸锌[Zn2(OH)2CO3],请写出碳化合成步骤的化学方程式 。
(5)在“洗涤”过程中,证明沉淀洗涤完全的标志是 。
(6)由于本工艺液固分离次数较多,明显的不足是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com