
(15)二氧化氯是黄绿色的气体,可用于水体消毒与废水处理。一种制备方法为:
__H2C2O4 +__NaClO3 +__H2SO4 →__Na2SO4+__CO2↑ +__ClO2↑ +__H2O
完成下列填空:
(1)配平上述反应方程式,该反应的还原产物是__________________________。
(2)该反应每产生0.2 mol ClO2,需要消耗草酸晶体(H2C2O4·2H2O)_________g。
(3)上述反应物中属于第三周期的元素的原子半径大小顺序是__________________________,
其中原子半径最大的元素最外层电子云形状为___________________________。
(4)二氧化氯具有强氧化性,能漂白有色物质,其漂白原理与__________相同。(写一种)
(5)二氧化氯能净化有毒废水中的氰化钠(NaCN),生成NaCl、CO2和N2,请写出此反应的离子方程式:_______________________________________________。
(6)上述反应产物NaCl中含有 __________键,工业上用电解熔融的氯化钠制备金属钠,氯气在_________(写电极名称)产生。
(1)1 2 1 1 2 2 2 (2分)ClO2(1分)(2)12.6(2分)(3)Na>S>Cl(2分);球形(1分)
(4)HClO(2分,合理即可)(5)2ClO2+2CN-→2CO2+N2+2Cl-(2分)
(6)离子(1分);阳极(2分)。
【解析】
试题分析:(1)根据在氧化还原反应中电子守恒、原子守恒可得该方程式是:H2C2O4 +2NaClO3 +H2SO4 →Na2SO4+ 2CO2↑ + 2ClO2↑ + 2H2O。在该反应中氧化剂是NaClO3,所以变成的还原产物是ClO2。(2)根据方程式可知:每产生2mol的ClO2,会反应消耗1mol的草酸,所以若该反应产生0.2 mol ClO2,需要消耗草酸晶体0.1mol,其质量是0.1mol ×126g/mol=12.6g. (3)在上述反应物中属于第三周期的元素有Na、S、Cl,同一周期的元素,元素序数越大,原子半径就越小,所以原子半径大小顺序是Na>S>Cl;(4)二氧化氯具有强氧化性,能漂白有色物质,其漂白原理与HClO、Na2O2、H2O2相同。(5)二氧化氯能净化有毒废水中的氰化钠(NaCN),生成NaCl、CO2和N2,该反应的离子方程式是:2ClO2+2CN-→2CO2+N2+2Cl-;(6)NaCl是离子化合物,其中的化学键是离子键;在工业上用电解熔融的氯化钠制备金属钠,根据同种电荷相互排斥,异种电荷相互吸引的原则,氯气是阴离子Cl-在阳极失去电子产生。
考点:考查氧化还原反应方程式的配平、方程式的书写、化合物的化学键类型的判断及有关计算的知识。


科目:高中化学 来源:2015届宁夏银川市高三上学期期中考试化学试卷(解析版) 题型:选择题
某合作学习小组讨论辨析以下说法,其中正确的是
①粗盐和酸雨都是混合物 ②沼气和水煤气都是可再生能源
③冰和干冰既是纯净物又是化合物 ④不锈钢和目前流通的硬币都是合金
⑤纯碱和熟石灰都是碱 ⑥豆浆和雾都是胶体
A.①③④⑥ B.①②⑤⑥ C.③⑤⑥ D.①②③④
查看答案和解析>>
科目:高中化学 来源:2015届天津一中高三化学9月考化学试卷(解析版) 题型:选择题
下列有关元素化合物的说法正确的是()
A.常温下,1mol铜片投入含有4mol HNO3的浓硝酸中,铜片可以完全溶解
B.Al与S直接化合可以得到Al2S3,Fe与S直接化合也可以得到Fe2S3
C.电解AlCl3、FeCl3、CuCl2的混合溶液中,阴极上依次析出Cu、Fe、Al
D.反应14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4,FeS2中的硫元素全部被氧化
查看答案和解析>>
科目:高中化学 来源:2015届四川省2015届高三9月理综化学试卷(解析版) 题型:填空题
(16分)某同学为了验证Fe3+是否能氧化H2SO3生成了SO42–,他用50mL0.1mol/LFeCl3溶液吸收制取SO2气体的尾气,再进行以下实验:
(1)检验吸收液中的SO42–: ,则证明Fe3+能把H2SO3氧化为SO42–。
(2)请配平并完成上述反应中的化学方程式:
2FeCl3+SO2+ ==2FeCl2+H2SO4+2HCl,反应中的氧化产物是 (写化学式)。
(3)吸收液中除了含有H+、Cl–、SO42–以外,对其它成份(Fe3+、Fe2+、H2SO3)的可能组合进行探究:
①提出假设。
假设1:溶液中存在Fe3+、Fe2+;
假设2:溶液中存在 ;
假设3:溶液中存在Fe2+ 而不存在H2SO3 (二者恰好完全反应)。
②设计方案、进行实验,验证假设。请在表中写出实验步骤以及预期现象和结论(可以不填满)。限选实验试剂和仪器:试管、滴管、0.1moL L-1KMnO4、0.1moL
L-1KMnO4、0.1moL L-1KSCN溶液、品红稀溶液。
L-1KSCN溶液、品红稀溶液。
实验步骤 | 预期现象和结论 |
步骤1:用试管取样品溶液2~3mL,再用滴管取 | 若出现血红色,则假设1成立;若未出现血红色,则假设2或假设3成立。 |
步骤2:
| 结合步骤1的现象和结论,
|
查看答案和解析>>
科目:高中化学 来源:2015届四川省2015届高三9月理综化学试卷(解析版) 题型:选择题
下列反应的离子方程式书写正确的是:
A.用硫氰化钾溶液检验Fe3+:Fe3++3SCN- = Fe(SCN)3↓
B.向海带灰浸出液中加入稀硫酸、双氧水:2I- + 2H+ + H2O2 = I2 + 2H2O
C.磨口玻璃试剂瓶被烧碱溶液腐蚀:SiO2+2Na++2OH- = Na2SiO3↓+H2O
D.NaHCO3溶液和少量Ba(OH)2溶液混合:HCO3- + OH-+ Ba2+ = H2O + BaCO3↓
查看答案和解析>>
科目:高中化学 来源:2015届四川省高三第三次理综考试化学试卷(解析版) 题型:选择题
下列各图示实验设计和操作合理的是 ( )
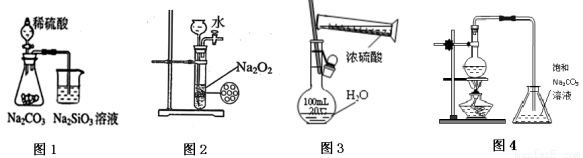
A.图1 证明非金属性强弱:S>C>Si B.图2 制备少量氧气
C.图3 配制一定物质的量浓度的硫酸溶液 D.图4 制备少量乙酸丁酯
查看答案和解析>>
科目:高中化学 来源:2015届四川省资阳市高三一诊理综化学试卷(解析版) 题型:选择题
将9 g铜和铁的混合物投入到100 mL稀硝酸中,充分反应后得到标准状况下1.12 L NO,剩余4.8 g金属;继续加入100 mL等浓度的稀硝酸,金属完全溶解,又得到标准状况下1.12 L NO。若向反应后的溶液中加入KSCN溶液,溶液不变红,则下列说法不正确的是
A.原混合物中铜和铁各0.075 mol
B.稀硝酸的物质的量浓度为2.0 mol·L
C.第一次剩余4.8 g 金属为铜和铁
D.向反应后的溶液中再加入该稀硝酸100 mL,又得到NO在标准状况下体积小于1.12 L
查看答案和解析>>
科目:高中化学 来源:2015届四川省绵阳市高三“一诊”模拟考试理综化学试卷(解析版) 题型:选择题
下列有关化学与生活说法中,不正确的是
A. 是世界通用的循环再生标志,简称回收标志
是世界通用的循环再生标志,简称回收标志
B.大量生产聚乙烯、聚氯乙烯一次性超薄袋,方便日常生活
C.75%的乙醇溶液常用来消毒,是因为酒精能够使细菌蛋白质发生变性
D.页岩气是从页岩层中开采出来的天然气。由于产气的页岩分布广、厚度大,且普遍含气,故可以成为新的化石燃料来源
查看答案和解析>>
科目:高中化学 来源:2015届四川省成都高新区高三11月统一检测化学试卷(解析版) 题型:选择题
下列说法中正确的是
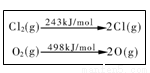
A.生成物总能量一定低于反应物总能量
B.同温同压下,H2(g)+Cl2(g)=2HCl(g) 在光照和点燃条件下的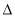 H不同
H不同
C.一定条件下,0.5 mol N2和1.5 mol H2置于某密闭容器中充分反应生成NH3气,放热19.3 kJ,其热化学方程式为N2(g)+3H2(g) 2NH3(g)
2NH3(g) 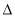 H =-38.6 kJ/mol
H =-38.6 kJ/mol
D.一定条件下4 HCl(g)+O2(g)=2Cl2(g)+2H2O(g) ,当1 molO2 反应放出115.6 kJ热量,键能如表所示,则断裂1 mol H-O键与断裂1 mol H-Cl键所需能量差为31.9 kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com