
![]() (10分)CO是一种无色、无味且不溶于水的有毒气体,其制法有:
(10分)CO是一种无色、无味且不溶于水的有毒气体,其制法有:
![]() (1)实验室可用甲酸和浓
(1)实验室可用甲酸和浓![]() 共热制取CO.
共热制取CO.
![]()
![]()
![]() a.甲酸和浓
a.甲酸和浓![]() 应怎样混合?浓
应怎样混合?浓![]() 起什么作用?
起什么作用?
![]()
![]() b.请据实验原理选择所需主要玻璃仪器(导管除外).
b.请据实验原理选择所需主要玻璃仪器(导管除外).
![]()
![]() c.怎样收集CO气体?
c.怎样收集CO气体?
![]() (2)实验室还可用草酸晶体与浓
(2)实验室还可用草酸晶体与浓![]() 共热制取CO.
共热制取CO.
![]()
![]()
![]() 请问:怎样才能得到不含
请问:怎样才能得到不含![]() 的CO气体?
的CO气体?
![]()
![]() (3)工业上用焦炭和水在高温下发生反应制取CO,其化学方程式为:____________
(3)工业上用焦炭和水在高温下发生反应制取CO,其化学方程式为:____________
![]() ____.在此条件下,C和
____.在此条件下,C和![]() 的还原性谁强?
的还原性谁强?
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:022
有一种无色混合气体可能含有CH4、NH3、H2、CO、CO2和HCl气体。进行如下实验:①此混合气体通过浓H2SO4气体总体积不变;②再通入澄清石灰水,气体体积变小但无浑浊现象;③剩余气体在空气中引燃,燃烧产物不能使无水硫酸铜变色。
(1)根据实验①可推断混合气体中没有_______,原因是__ _____。
(2)根据实验③可推断混合气体中没有_______,原因是____ ___。
(3)混合气体中肯定有_____ __。
(4)上述实验_______(填“有”或“没有”)不能肯定或否定的气体。若有,则是_______气体。
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:022
(1)根据实验①可推断混合气体中没有_______,原因是__ _____。
(2)根据实验③可推断混合气体中没有_______,原因是____ ___。
(3)混合气体中肯定有_____ __。
(4)上述实验_______(填“有”或“没有”)不能肯定或否定的气体。若有,则是_______气体。
查看答案和解析>>
科目:高中化学 来源:2013届江苏省徐州市高三模底考试化学试卷(带解析) 题型:填空题
(12分)无水A1C13可用作有机合成的催化剂,食品膨松剂等。工业上由铝土矿(主要成分是A12O3和Fe2O3)和石油焦(主要成分是碳单质)制备无水A1C13的流程如下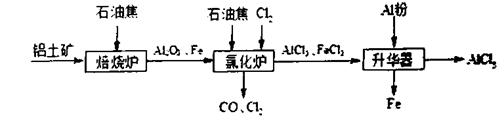
(1)在焙烧炉中发生反应:①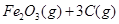
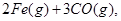
②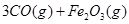

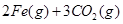 。则反应②的平衡常数的表达式为K= 。
。则反应②的平衡常数的表达式为K= 。
(2)氯化炉中A12O3,C12和C在高温下反应的化学方程式为 ;其炉气中含有大量CO和少量C12,可用 溶液除去C12,并回收CO。
(3)升华器中主要含有A1C13和FeC13,需加入一定量A1,其目的是 。
(4)工业上另一种由铝灰为原料制备无水A1C13工艺中,最后一步是由A1C136H2O脱去结晶水制备无水A1C13,直接加热不能得到无水A1C13,其原因是 。已知SOC12为无色液体且极易与水反应生成HC1和SO2,A1C136H2O与SOC12混合加热可制取无水A1C13,写出该反应的化学方程式:
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江苏省徐州市高三模底考试化学试卷(解析版) 题型:填空题
(12分)无水A1C13可用作有机合成的催化剂,食品膨松剂等。工业上由铝土矿(主要成分是A12O3和Fe2O3)和石油焦(主要成分是碳单质)制备无水A1C13的流程如下
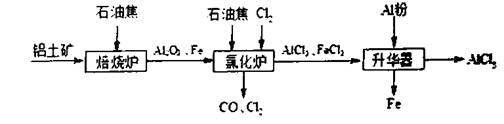
(1)在焙烧炉中发生反应:①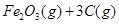

②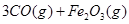

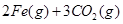 。则反应②的平衡常数的表达式为K=
。
。则反应②的平衡常数的表达式为K=
。
(2)氯化炉中A12O3,C12和C在高温下反应的化学方程式为 ;其炉气中含有大量CO和少量C12,可用 溶液除去C12,并回收CO。
(3)升华器中主要含有A1C13和FeC13,需加入一定量A1,其目的是 。
(4)工业上另一种由铝灰为原料制备无水A1C13工艺中,最后一步是由A1C136H2O脱去结晶水制备无水A1C13,直接加热不能得到无水A1C13,其原因是 。已知SOC12为无色液体且极易与水反应生成HC1和SO2,A1C136H2O与SOC12混合加热可制取无水A1C13,写出该反应的化学方程式:
查看答案和解析>>
科目:高中化学 来源: 题型:
![]() 钛呈银白色,因它坚硬、强度大、耐热、密度小,被称为高技术金属。目前生产钛采用氯化法,即将金红石或钛铁矿与焦炭混合,通入氯气并加热制得TiCl4:
钛呈银白色,因它坚硬、强度大、耐热、密度小,被称为高技术金属。目前生产钛采用氯化法,即将金红石或钛铁矿与焦炭混合,通入氯气并加热制得TiCl4:
![]() 2FeTiO3+7Cl2+6C 2TiCl4+2FeCl3+6CO
2FeTiO3+7Cl2+6C 2TiCl4+2FeCl3+6CO
TiO2+2Cl2+2C TiCl4+2CO
![]() 将TiCl4蒸馏并提纯,在氩气保护下与镁共热得到钛:
将TiCl4蒸馏并提纯,在氩气保护下与镁共热得到钛:
TiCl4+2Mg Ti+2MgCl2
MgCl2和过量Mg用稀盐酸溶解后得海绵状钛,再在真空熔化铸成钛锭。
请回答下列问题:
(1)基态钛原子的价电子排布式为 。
(2)与CO互为等电子体的离子为 (填化学式)。
(3)在CH2Cl2、C6H6、CO2、C2H4中,碳原子采取sp1杂化的分子有 。
(4)TiCl4在常温下是无色液体,在水或潮湿空气中易水解而冒白烟。则TiCl4属于
(填“原子”、“分子”或“离子”)晶体。
|
(6)在自然界中TiO2有金红石、板钛矿、锐钛矿三种晶型,其
中金红石的晶胞如右图所示,则其中Ti4+的配位数为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com